《Cell》:胶质母细胞瘤模型再现肿瘤异质性
生 物 智 造 创 建 美 好 生 活
Intelligent Biomanufacturing Creates Better Life
胶质母细胞瘤是成人中最普遍的原发性恶性脑肿瘤,由于其恶性程度和侵袭性,是非常致命的疾病。尽管有许多临床试验,十多年来的标准治疗方法是最大限度的手术切除,然后是替莫唑胺化疗和放射治疗,与单独手术和放射治疗的12.1个月相比,生存期的中位数提高到14.6个月。人们越来越认识到,肿瘤之间和肿瘤内部的分子异质性可能导致众多临床试验的不良结果。表征这种异质性和开发新的模型来及时对胶质母细胞瘤的个性化治疗策略进行测试,是临床前后都存在的挑战。
来自宾夕法尼亚大学医疗中心Donald M. O'Rourke团队的Fadi Jacob等作者报告了一种在确定的培养基中直接从新鲜的肿瘤标本中快速生成胶质母细胞瘤类器官(命名为GBO),而无需单细胞分离。作者生成了一个GBO的活的生物样本库,并进行了全面的组织学、分子和基因组分析,显示GBO再现了肿瘤间和肿瘤内的异质性,并保留了其相应亲本肿瘤的许多关键特征。这些GBO可以被有效地异种移植到成年小鼠的大脑中,显示出快速和侵略性的浸润,并保持关键的驱动突变表达。作者进一步表明,在临床相关的时间范围内,GBO可以被用来测试对标准护理疗法以及靶向治疗的反应,包括临床试验药物和嵌合抗原受体T(CAR-T)细胞免疫疗法。
这些结果突出了源于患者的胶质母细胞瘤类器官模型和生物样本库在基础和转化研究以及测试个性化疗法方面具有巨大潜力。
01
胶质母细胞瘤类器官的培养和储存
为了保留原始肿瘤的局部细胞结构和原始细胞间的相互作用,并避免在培养中对特定的细胞群进行克隆选择,作者开发了一个方法来生成胶质母细胞瘤类器官(GBO),而无需将切除的肿瘤组织机械或酶解为单细胞(图1A)。最佳的GBO是由沿肿瘤边缘的组织产生的,坏死程度最小,周围的脑组织很少。这些GBO显示了患者肿瘤的细胞和核不典型性,通常含有丰富的有丝分裂的数字和多形核(图1B)。许多GBO还保留了CD31+血管(图1C)。允许GBO生长得更大,形成缺氧梯度(图1D),这是胶质母细胞瘤的一个标志。低氧在离表面300毫米左右大幅增加,与KI67+增殖细胞的缺失相关(图1D)。
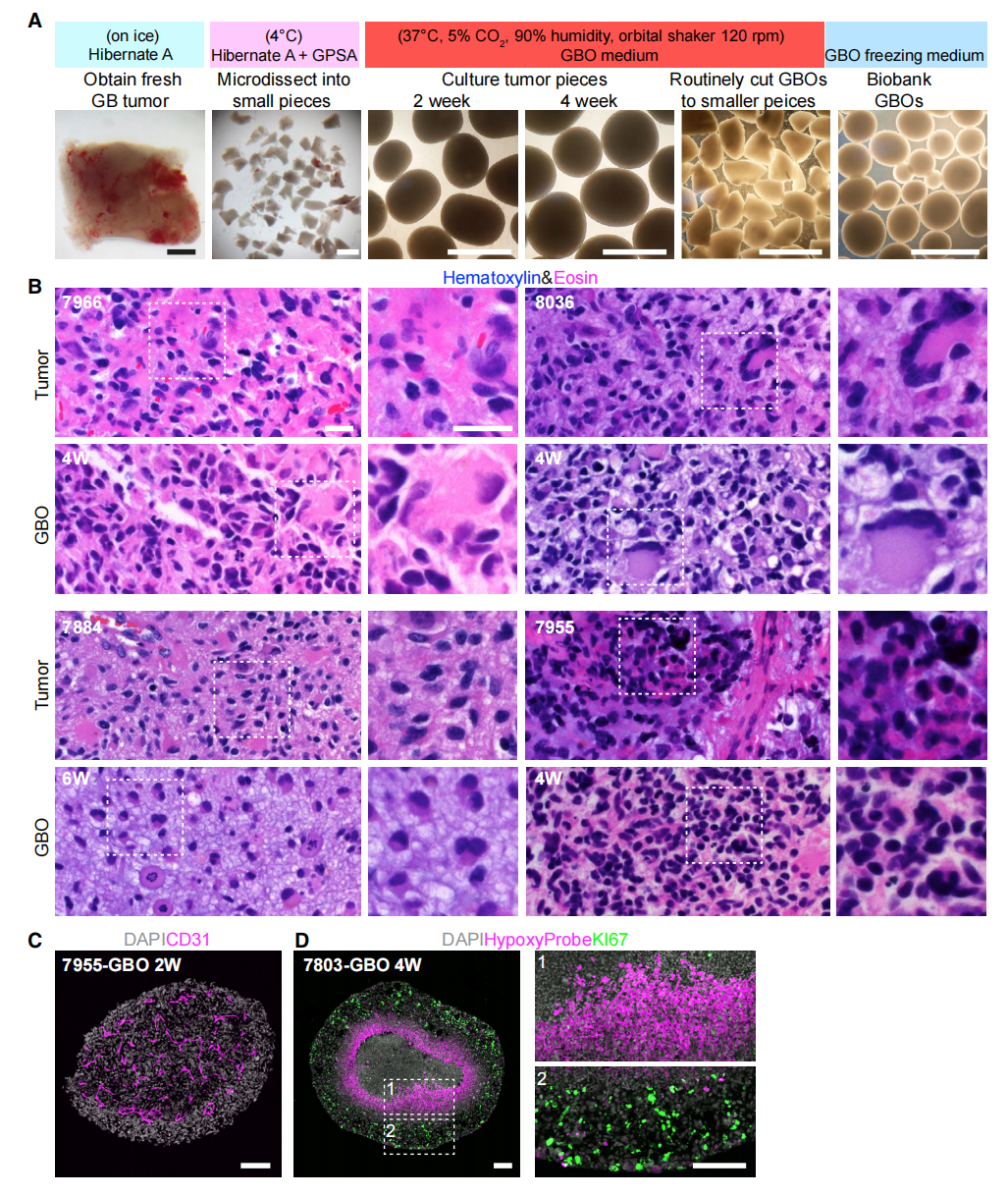
图1. 保留亲本肿瘤组织学特征的GBO的产生
作者观察到GBO中细胞身份和形态的高度异质性,与相应的亲本肿瘤的细胞组成非常相似,表现出明显的肿瘤间异质性(图2A和S1A)。两周后,表达EdU的细胞包括NESTIN+、HOPX+、DCX+、S100B+、OLIG2+和GFAP+细胞,表明通常存在于亲本肿瘤中的不同细胞类型能够持续增殖(图2A和2D)。作者还开发了冻存GBO和从冷冻保存中恢复它们的方法。这些恢复的GBO表现出持续的生长(图2E和2F),各种标记物的表达与它们相应的亲本肿瘤相似(图2A、2B、S1和S2D)。
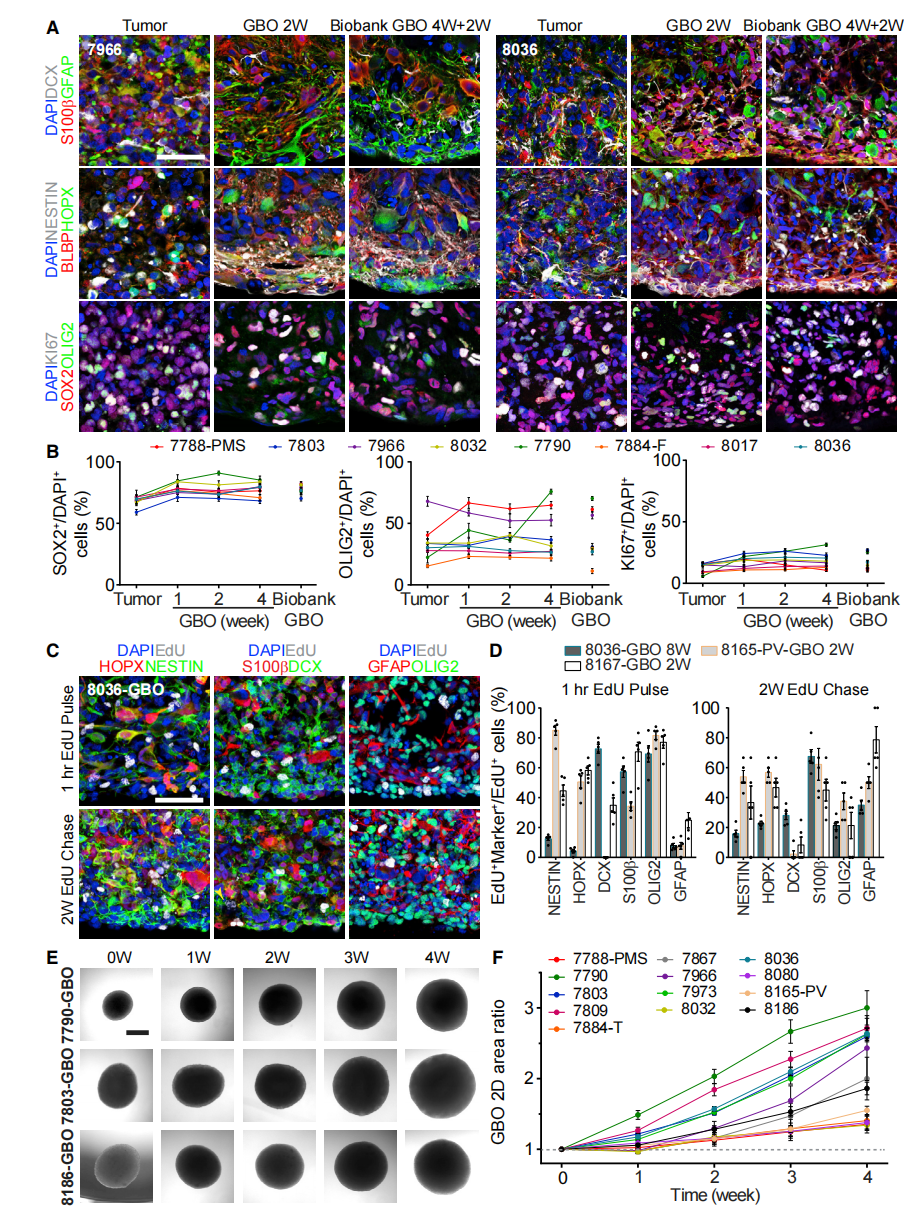
图2. GBO保留并不断产生异质性细胞群
02
通过GBO维持分子和
突变的瘤间和瘤内异质性
GBO与它们相应的亲本肿瘤的转录组比较显示出高度的相似性(图3A和S3A)。鉴于胶质母细胞瘤有很大的肿瘤间异质性,作者确定了单个亲本肿瘤的独特基因表达特征,并发现相应的GBO在培养过程中随着时间的推移保持了这些基因表达模式(图3B)。在亲本肿瘤中发现的大部分体细胞变异在相应的GBO中发现了,其等位基因频率相似(图3C;表S3)。亲本肿瘤中检测到的拷贝数变异(CNVs)也在相应的GBO中以相似的拷贝数比率被发现(图3C和S3G)。在相应的GBO中,肿瘤间的异质性基本上被保留下来(图3C)。基因表达分析也显示,GBO保持了亚区肿瘤样本的特征(图3B和3D)。这一点通过免疫组织学得到进一步证实(图3G)。
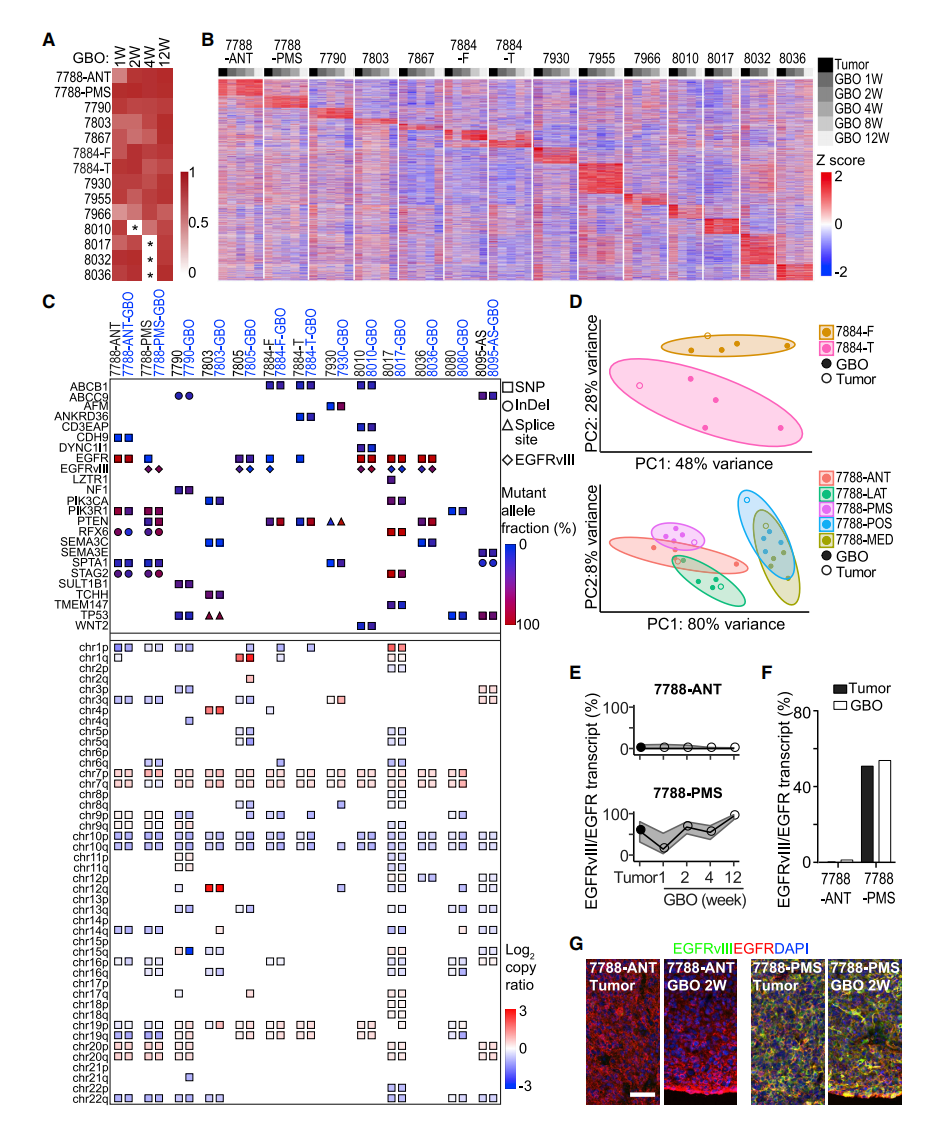
图3:GBO保持了相应亲本肿瘤的基因表达和突变概况在肿瘤间和肿瘤内的异质性
03
GBO对细胞类型异质性
和分子特征的维持
在单细胞水平上,由拷贝数改变(CNA)状态和标记基因表达(图S4A)确定的来自亲本肿瘤和衍生GBO的肿瘤细胞表现出患者特有的聚类,而来自不同患者的非肿瘤细胞类型如巨噬细胞/微胶质细胞、T细胞、基质细胞和髓鞘少突胶质细胞则聚在一起(图4A和4B)。巨噬/小胶质细胞在2周时在亲本肿瘤和GBO中表现出类似的许多免疫相关基因的表达。这表明肿瘤微环境的某些特征在GBO中得以保持(图4C)。作者发现在后来的时间点上,亲本肿瘤和相应的GBO在2周时的细胞分布相似(图4F,S4B和S4G),这表明GBO在培养的延长时间内保持了亲本肿瘤的细胞类型和分子特征。在亲本肿瘤和相应的GBO中,2周后发现了许多不同的细胞簇(图4G、S4C和S4H),反映了细胞类型和细胞状态的多样性。通过对整个转录组基因表达的配对比较,GBO细胞簇与亲本肿瘤细胞簇的相似度很高,表明GBO在很大程度上保持了亲本肿瘤的细胞异质性(图4H、S4D和S4I)。
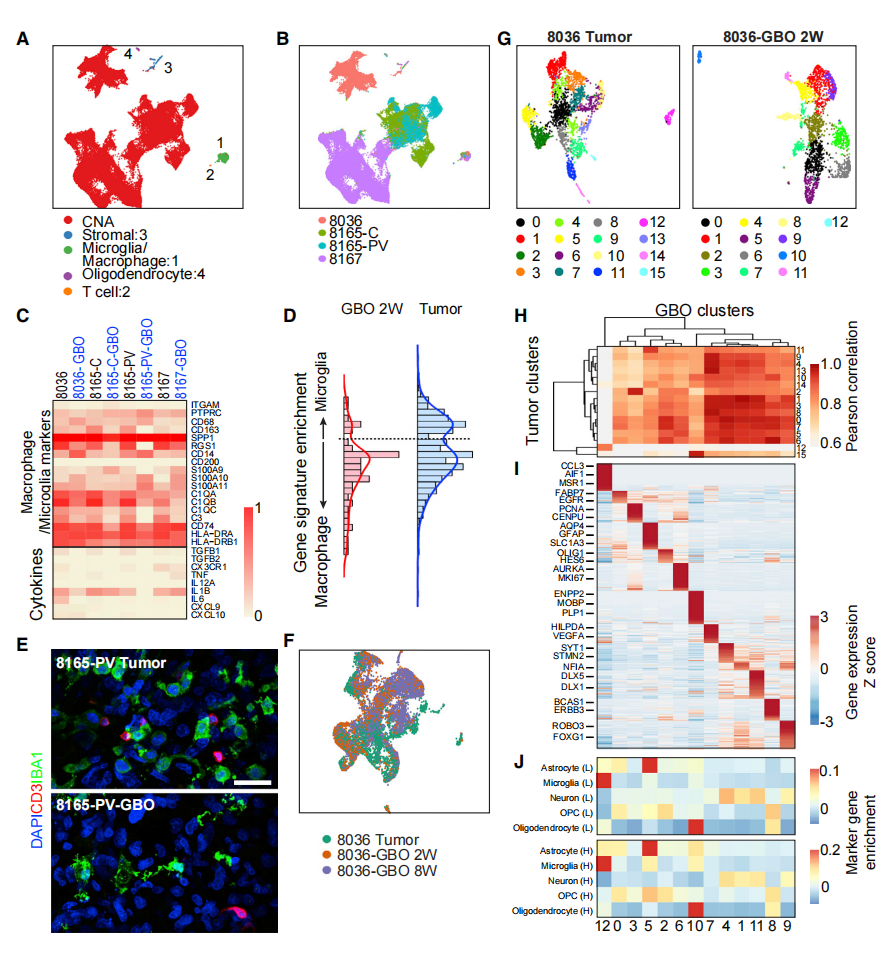
图4. 亲本肿瘤和相应的GBO的单细胞RNA-Seq分析
04
GBO在异种模型中
的高效移植和浸润
胶质母细胞瘤的一个主要标志是肿瘤细胞向周围脑组织的浸润,这通常与患者MRI扫描的FLAIR信号有关(图5A)。移植后2个月,通过H&E染色和对异种移植的UP-7788-PMS和UP-7790 GBO的分析显示,原始异种移植部位和浸润区域的组织结构与相应的亲本肿瘤相似(图5B)。作者通过人类特异性抗原HuNu和STEM121的免疫组织学证实了GBO衍生细胞的同侧和对侧广泛浸润(图5C-5F)。与胶质母细胞瘤的高血管生成特征相一致,所有异种移植的GBO在移植后2个月都被宿主Endoglin+内皮细胞广泛地血管化(图5D,5F,和S5D;表S5)。在最初的异体移植部位和远处的浸润区域都发现了KI67+增殖细胞和SOX2+或NESTIN+祖细胞群(图5D、5F和S5D)。在作者的模型中,EGFR扩增和EGFRvIII突变体的表达都被来自EGFR扩增和EGFRvIII+肿瘤的GBO保留在异体移植部位和浸润区(图5D和S5D)。
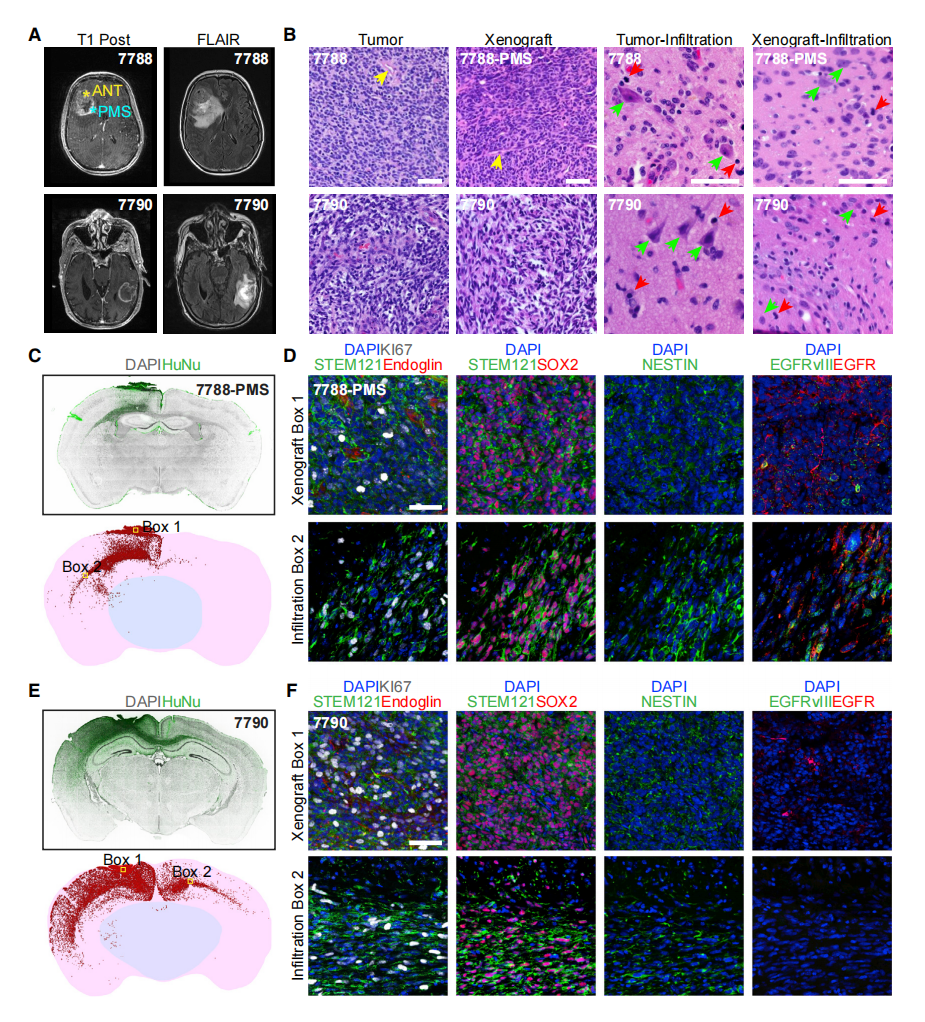
图5. 原位移植GBO到成年免疫缺陷小鼠体内显示出高效的移植和对脑实质的广泛浸润
05
利用GBO建立靶向
药物治疗的模型
作者没有发现GBO反应和MGMT甲基化之间有明显的关联(图6A和6B)。GBO中KI67+细胞的减少(图6F),表明仅有突变分析而没有功能检测,不足以预测治疗反应。吉非替尼反应者的GSEA富集了与EGF信号和免疫相关的CCR5信号相关的基因组,而吉非替尼耐药组富集了与干细胞相关的神经发育相关的基因组(图6G和S6D;表S6)。作者测试了MEK抑制剂trametinib(1mM)来抑制NF-1下游的信号传导(图6D)。NF1突变体的GSEA富集了与RAS信号传导和血管生成有关的基因组(图6J和6K;表S6),而NF1 WT组富集了与PI3K靶点磷脂酰肌醇的酰基链重塑(图6N)和谷胱甘肽共轭(图S6E;表S6)有关的基因组,这与耐药性有关。作者接下来测试了抑制PI3K诱导的mTOR激活对NF1 WT肿瘤的影响(图6D)。
用依维莫司(1mM)治疗具有PI3K突变的UP-7803-GBO,KI67+细胞几乎完全减少(图6L和6M)。同时,处理UP-8017-GBOs,其在RAS和PI3K途径的上游有一个EGFR的改变,有部分KI67+细胞的减少(图6M)。相比之下,UP-7790-GBOs,它在平行的RAS途径上有一个突变,没有显示任何减少(图6L和6M)。
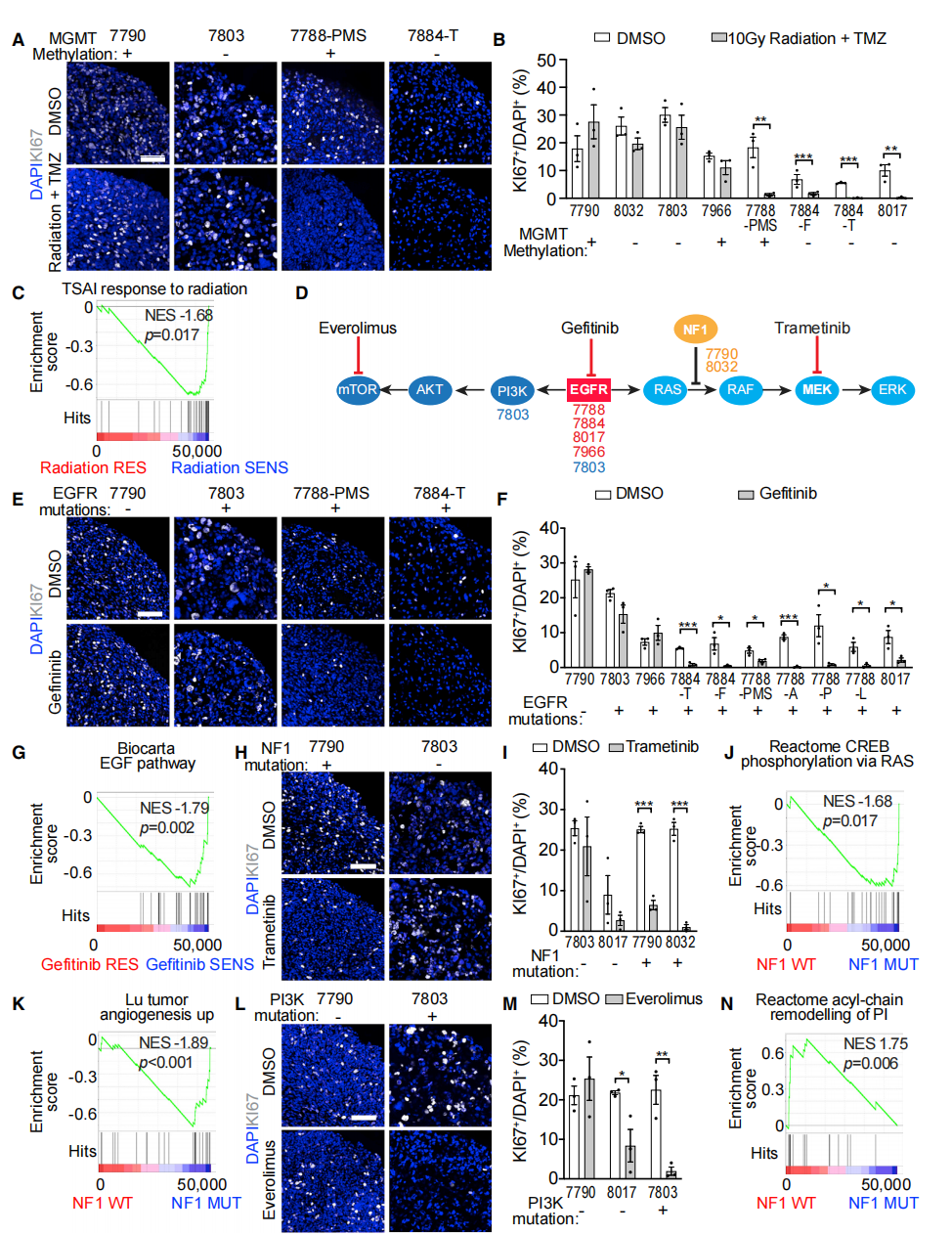
图6. GBO的体外治疗测试
06
利用GBO建立个性化的
CAR-T免疫疗法模型
作者测试了CAR-T细胞与6个GBO样本的共培养,包括含有高和低EGFRvIII+细胞百分比的GBO,以及两对来自肿瘤亚区采样的GBO,其中一个亚区含有高百分比的EGFRvIII+细胞,另一个亚区没有),并通过免疫染色证实(图7A 和S7A )。CD19和2173BBz CAR-T细胞都侵入了所有的GBO,但只有当2173BBz CAR-T细胞与EGFRvIII+的GBO共培养时,才观察到CAR-T细胞的明显扩增图7A和S7A)。CD3+T细胞明显增加。这种CAR-T细胞扩增的增加,伴随着Caspase-3信号的增加和GBO中EGFRvIII/EGFR信号强度比例的降低(图7A、7C和7D),表明EGFRvIII+细胞被2173BBz CAR-T细胞锁定并杀死。许多EGFR+ EGFRvIII的肿瘤细胞在加入CART的3天后仍然存在(图7A和S7A),表明2173Bbz CAR-T细胞虽然对其目标有很强的特异性,在此实验的条件下无法完全根除所有肿瘤细胞。
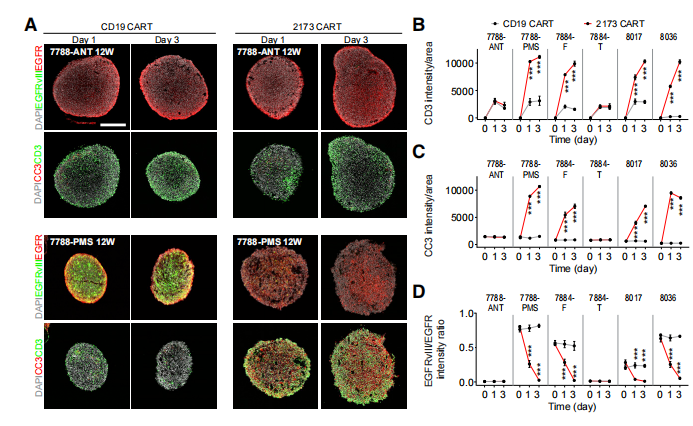
图7. 用CAR-T细胞和GBO共同培养的免疫疗法模型
结论
本文报道的GBO再现了其相应的亲本肿瘤的异质性,具体表现为:(1)组织学显示类似的组织结构和细胞形态;(2)免疫组织学显示类似的各种细胞类型的存在和持续产生、 (3) RNA-seq显示维持类似的转录组特征,(4) 全外显子组测序证实体细胞变异和CNVs的频率相似,以及(5) 单细胞RNA-seq显示维持不同的细胞群及其基因表达谱。通过将完整的GBO移植到小鼠体内,实现了高效的异种移植,并显示出快速、恶性的浸润。这项GBO生成方法具有高通量,可以进行有针对性的测试,从而有可能加速个性化医疗并影响临床决策。
鉴于大多数胶质母细胞瘤患者诊断后的生存期很短,测试个性化治疗策略的时机至关重要。作者的方法可以在最初的手术切除后1-2周内从广泛的胶质母细胞瘤中生成患者来源的GBO。未来的研究可以在治疗开始前用来自多个肿瘤亚区的GBO测试几种治疗策略的有效性。作者的GBO移植模型在一个月内表现出快速和积极的浸润表型,可用于及时测试体内的治疗反应。
目前局限
IDH1突变肿瘤和复发肿瘤的GBO建模成功率降低(分别为66.7%和75.0%)。可能需要进一步优化,以更有效地建立这些模型。随着时间的推移,GBO中的血管和巨噬细胞/微胶质细胞群的丰度下降,以及免疫相关基因的表达降低,与原发性肿瘤产生差异。常驻的免疫细胞的寿命有限,不增殖就会被比例降低。未来涉及免疫微环境的研究最好在GBO建立后的早期进行,或添加外源免疫细胞后进行。
原文出处:https://doi.org/10.1016/j
关于赛箔生物
赛箔生物致力于开发生物3D打印、生物材料、体外检测组织产品、再生器官产品,并且基于相关产品开发精准的检测评价方法及服务。目前已开展数百例肿瘤临床样本的生物3D打印微组织构建,经过大量实验研究及一致性验证,能够构建与患者组织高度一致的肿瘤微组织用于药敏检测,涵盖癌种包括肺癌、结直肠癌、脑胶质瘤、神经母细胞瘤、肝母细胞瘤、膀胱癌等高发癌种、难治肿瘤、儿童肿瘤,成功率>90%,可实现1-2周内完成采样至完成药敏检测流程。


生物3D打印技术,是一项前沿生物制造技术,能够用于制造例如类器官、器官芯片等具有不同尺寸规格、复杂程度的体外3D细胞组织模型。结合与人体组织高度相似的仿生生物材料及患者细胞,可以精确地复制患者肿瘤组织的细胞及细胞外基质特征。通过生物3D打印建立的肿瘤微组织与患者肿瘤组织中突变基因及突变类型保持高度一致。作为一项工程技术,能够更高效率、批量化地建立高重现性、高精度的模型。这些优势都使得生物3D打印技术在肿瘤精准医疗研究和临床应用中具有巨大的潜力。
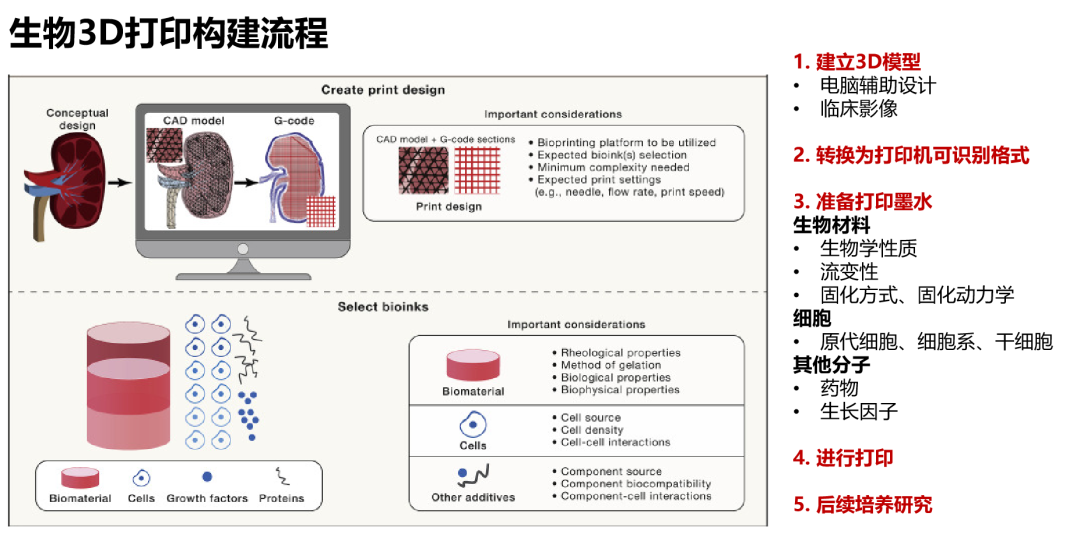
通过生物3D打印建立的肿瘤微组织,可以为患者提供个体化的治疗方案药物敏感性检测,包括类器官可检测的化疗药物、靶向药物。同时,在多种癌种,包括肺癌、结直肠癌等癌种中,生物3D打印为组织中可检测出较高比例免疫细胞,同时由于生物3D打印可以进行不同细胞组合的微组织模型制作,因此也可进行免疫治疗药物的检测,更好地满足患者的需求。

如选择通过生物3D打印技术建立肿瘤微组织,大部分注意事项可参考专家共识针对肿瘤类器官的注意事项,此外运输时间方面相对类器官较为宽裕。目前样本质量、体积达标的情况下,在24小时内送达,均可实现>90%的构建成功率。
生物3D打印作为一种生物制造技术平台即将迭代为一种重要的生命科学工具,利用工程技术构建和模拟人体组织微环境,可涵盖包括类器官、器官芯片等3D模型的制造,从而代替动物实验。在药物研发临床前研究与评价的应用日趋明朗。
✦ ✦✦ ✦✦ ✦✦ ✦
关注我们获取更多咨询

✦ ✦ ✦ ✦ ✦ ✦ ✦ ✦
部分图片文字来自网络,若有侵权,请联系删除。
生物智造创建美好生活
Intelligent Biomanufacturing Creates Better Life
产品
科研服务
走进赛箔
资源中心
联系我们

