《Nature Communication》:肺癌类器官
生 物 智 造 创 建 美 好 生 活
Intelligent Biomanufacturing Creates Better Life
肺癌在个体间具有高度的遗传和表型的异质性,使得个性化医疗成为需求。来自韩国首尔峨山医院Center for Precision Medicine的Kim Minsuh以及团队创建了一个由5种亚型肺癌和5种正常支气管器官(NBOs)的80个肺癌类器官(LCO)系组成的生物样本库。肺癌类器官再现了原发性肺肿瘤的组织结构,并在体外的长期扩增过程中保持了原始肿瘤的基因组改变。正常支气管器官拥有正常支气管黏膜的细胞成分。肺癌类器官根据其基因组改变产生药物反应。LCOs和NBOs生物样本库保持了其各自亲本组织的组织学和遗传学特征,并可用于研究患者特定的药物试验,以及靶向治疗和抗性机制的概念验证。
01
LCOs是由五种亚型的
癌症组织建立的
LCOs经过6个月的长期扩增培养,球状的类器官形态没有变化,并保持了增殖能力(图1b)。有23个样本成功建立了2D培养模型,20个样本成功生成了LCOs,10个样本成功生成了源于患者的异种移植模型(PDXs)(图1d)。在不同的肺癌亚型中,类器官培养的成功率没有差异(图1d)。作者对生物样本库中冷冻保存的类器官进行了复苏试验。使用3D培养方法,56个LCOs中有39个(70%)成功重现了原始组织的类器官形态和组织学特征(图1f)。
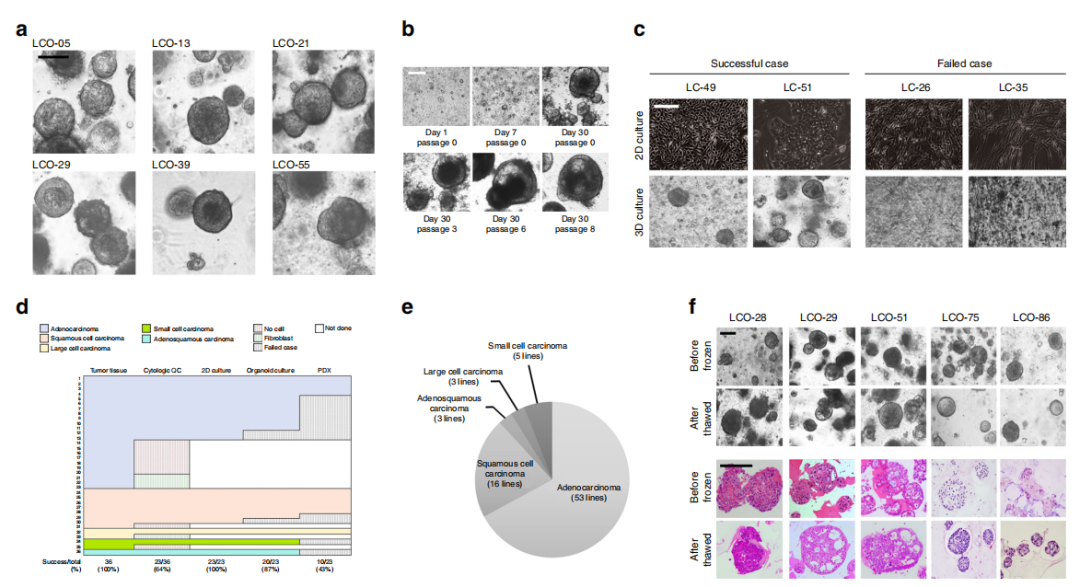
图1:为肺癌生物样本库建立的LCOs
02
LCOs保持了原始癌症
组织的组织学特征
与其亲本癌组织相似,源自腺癌的LCOs产生腺泡状或大腺状结构,并保留肺腺癌标志物napsin-A、TTF1和CK7的表达(图2a)。腺鳞状LCOs保留了原始患者肿瘤组织中看到的腺癌和鳞状细胞癌的混合组织学特征。它们还再现了原始癌症组织的标记物表达模式(图2c)。单细胞分析显示类器官结构似乎是由腺癌和鳞癌成分组成(图2e)。小细胞肺癌类器官显示出典型的小细胞形态,即密集的小圆形肿瘤细胞,细胞质稀少,细胞核呈颗粒状。在相应的癌症组织中观测到小细胞癌的诊断标志物的表达(图2d)。
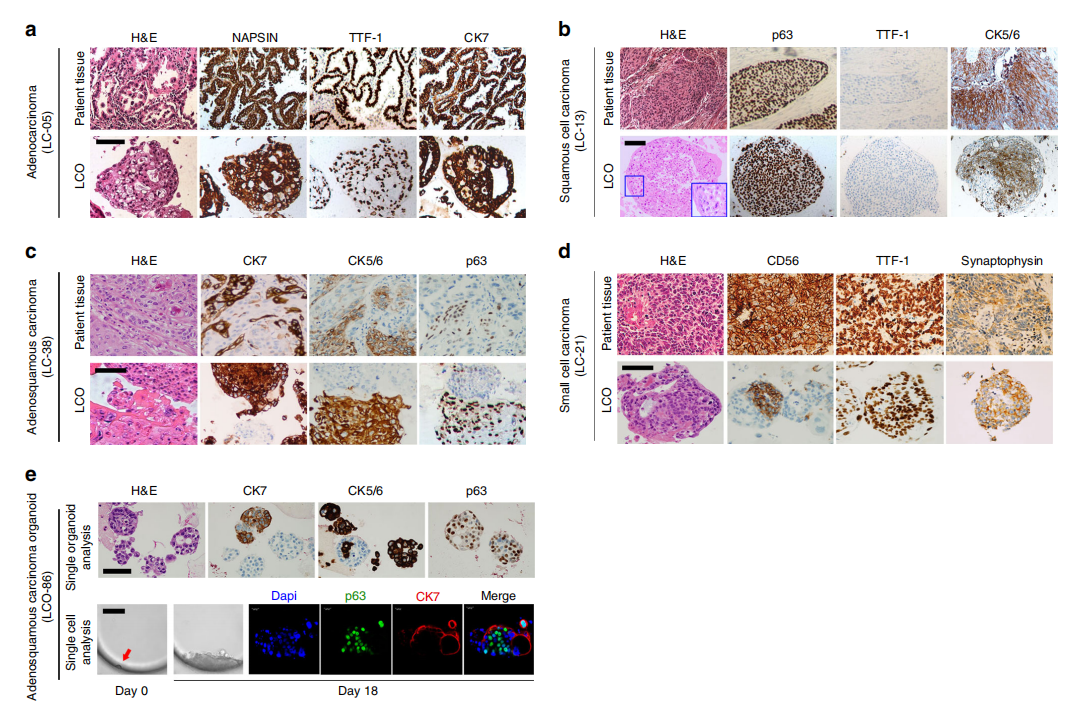
图2:LCOs再现了原始组织的特征
03
LCOs保留了癌症组织的遗传特征
LCOs也保留了对应肺癌组织中的大多数体细胞突变,SNP基因分型的一致性为100%。LCOs保留了大多数变异,包括其原始癌症组织的驱动突变。这些类器官中的变异等位基因分频率(VAF)分布通常保持了原始癌症组织中的VAF分布(图3d)。有3个病例中类器官中的突变数量显示多于原始组织,类器官的特异性突变很可能以较低的频率存在于原发肿瘤中,而不是真正的新突变,因为原发肿瘤组织含有的正常细胞降低了VAF(图3d)。类器官中突变的数量在后来的代次中有所增加,这可能由亚克隆扩展导致(图3f)。
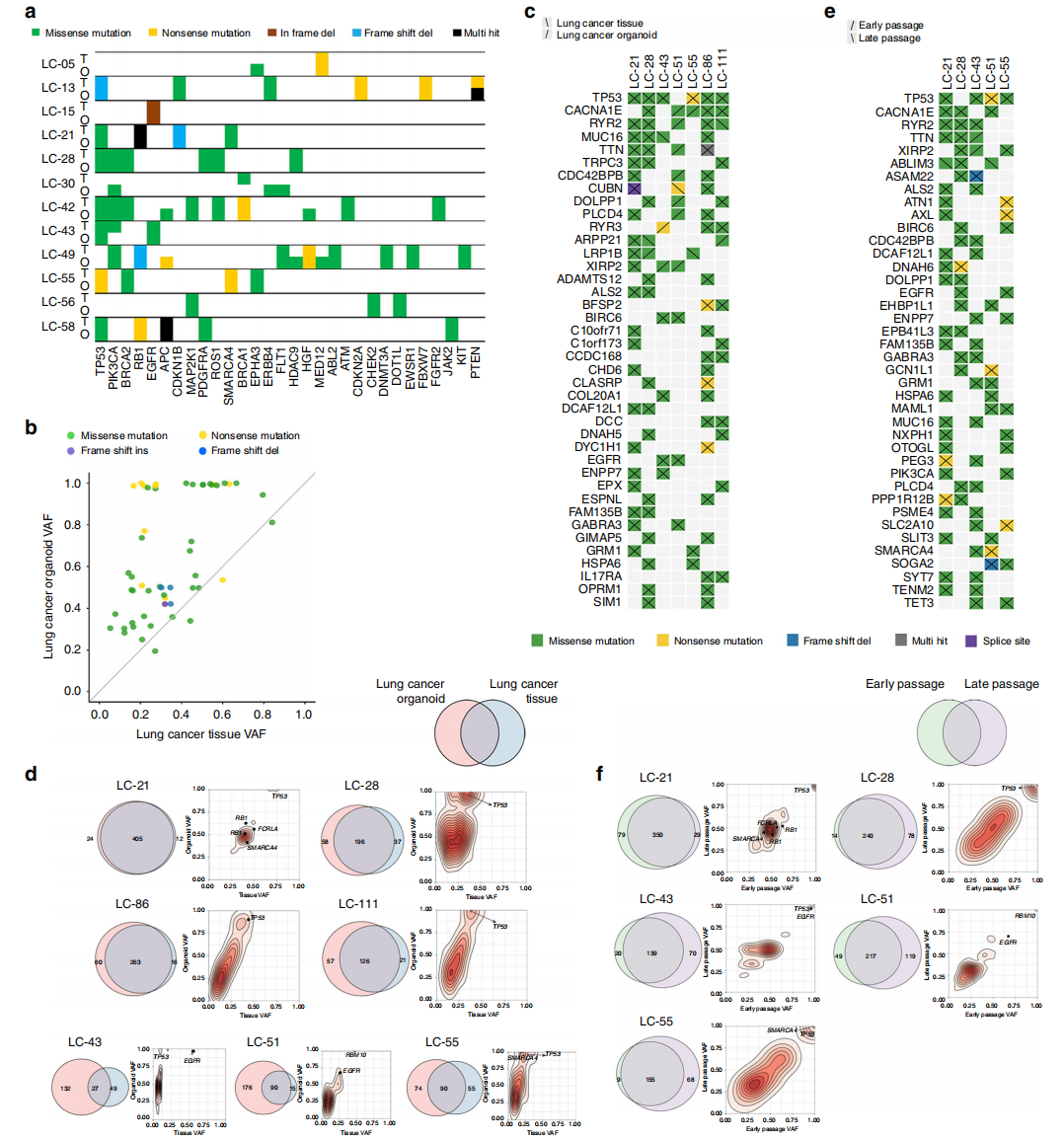
图3 :LCOs在长期培养后保留了原始组织的遗传特征
04
NBOs保持了支气管
上皮的组织结构
作者通过调整培养基,成功实现支气管细胞在10次传代后都能够成功形成NBO(图4a)。NBO从第4次传代开始出现了出芽的小管状类器官,并在随后的10次传代的中长期保持这种形态(图4a)。H&E数据显示,NBO具有由基底细胞和管腔细胞组成的假层上皮,包括分泌细胞和纤毛细胞,如同正常的支气管粘膜组织(图4b)。NBOs中的细胞类型分布与LCOs中的不同。
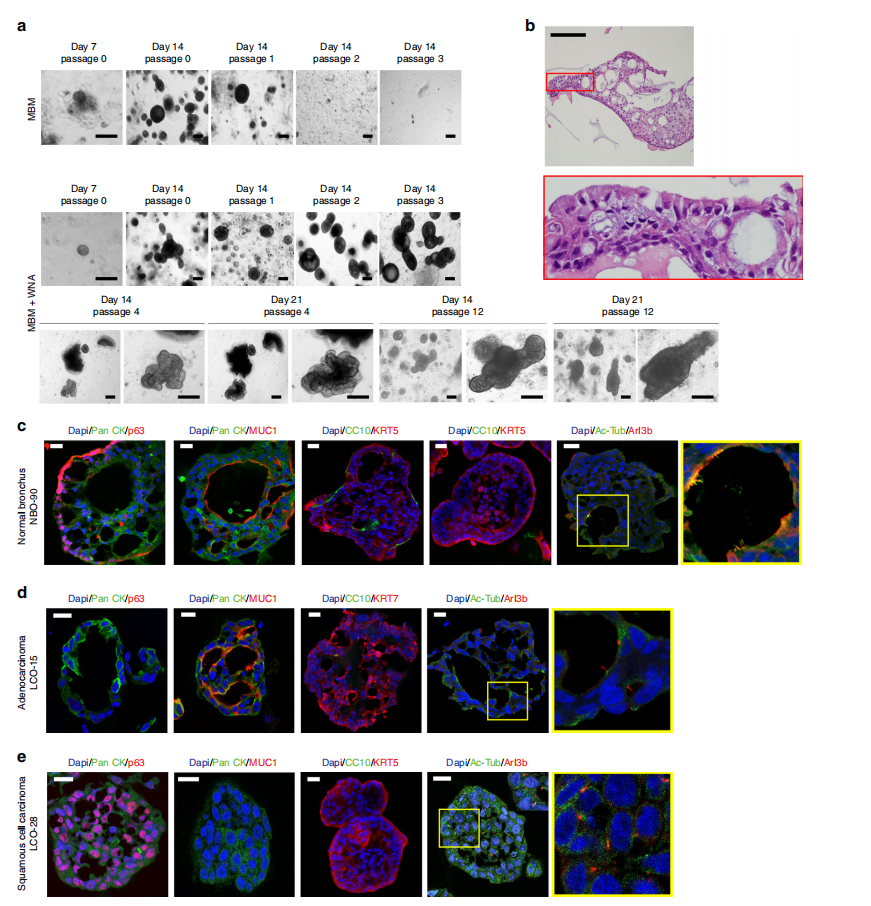
图4 :NBOs和LCOs的类器官结构
05
LCOs保持致瘤特性
作者将2D细胞与LCO植入小鼠体内。6个2D培养细胞中只有2个产生了肿瘤(图5a, b),而所有移植的LCOs都在小鼠体内产生了肿瘤,且肿瘤更大、时间更短,(图5c)。
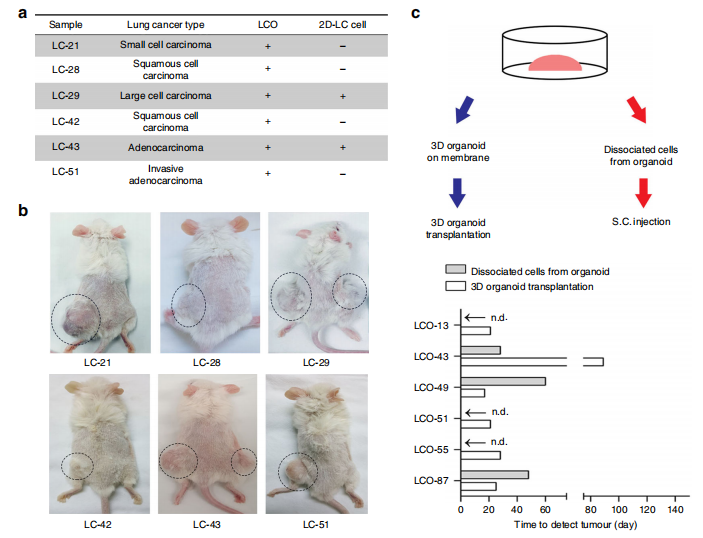
图5 :来自LCOs的PDXs保持了原始组织的特征
06
LCOs保持PD-L1的表达
作者通过IHC测试LCOs和PDXs的PD-L1表达,并与原始肿瘤组织进行比较。10个原始肿瘤组织中有两个表达了PD-L1,在匹配的LCOs和PDXs中也观察到同样的模式。
07
用于体外患者特异性
药物试验的LCOs
与靶向药物Olaparib、Erlotinib和Crizotinib相比,NBO对细胞毒性药物多西他赛的敏感性显著更高(图6)。由于LCOs源于未用药患者的癌症组织,作者推测样本LCO-51对厄洛替尼的耐药性可能与其组织内在的抗性机制有关。根据基因组数据的拷贝数分析,LCO-51具有MET的扩增,这与对EGFR酪氨酸激酶抑制剂的耐药性有关(图6d)。
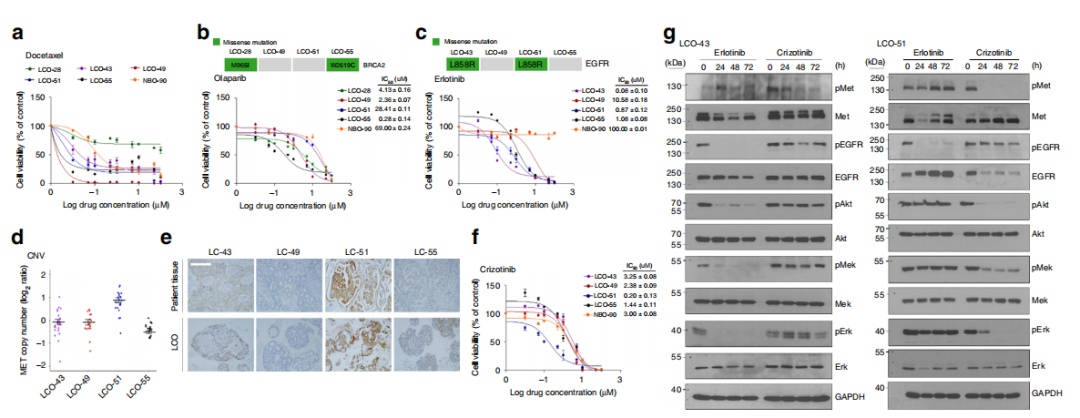
图6:LCOs作为预测治疗反应的平台
小结
代表个体患者的体外肺癌模型将促进肺癌个体化药物的发展。本文中,作者描述了一种成功和有效地产生LCOs的方法,这些LCOs再现了原始患者肿瘤的特征。作者建立了一个由80个LCOs组成的生物样本库,这些LCOs来自五个肺癌亚型,涵盖了95%以上患者的肺癌类型。LCOs保持了原始癌症组织的组织学特征。同时,作者采用了一种次优培养基,用于LCOs的高效培养,而不会受到正常细胞污染的困扰。该培养基同时也是NBOs的最佳培养基。此外,LCO衍生的异种移植保持了其亲代器官和原始癌症组织的特征。由3D-LCOs制成的异种移植模型不仅有利于产生大量的PDXs,也有利于研究基质细胞、免疫细胞和癌症器官之间的体内相互作用。最后,对LCOs的药物测试也发现了耐药性的潜在差异。尽管LCO-43和LCO-51具有相同的EGFR突变,但由于不同的次级改变,它们对厄洛替尼和克唑替尼的反应不同。在个性化癌症医学时代,与涉及大量不同患者群体的经典临床设计相比,药物再利用试验、药物组合试验和nof-1试验的新临床试验设计正变得越来越重要。本研究显示生物样本库中的LCOs可用于抗癌药物筛选,或用于预测个别患者药物反应的体外试验。LCOs可能有助于比较多种辅助疗法的疗效。在临床过程中对个别患者进行纵向取样,促进癌症治疗的个性化,以及通过与正常肺类器官的比较来评估药物的毒性。
原文出处:
https://doi.org/10.1038/s41467-019-11867-6
关于赛箔生物
赛箔生物致力于开发生物3D打印、生物材料、体外检测组织产品、再生器官产品,并且基于相关产品开发精准的检测评价方法及服务。目前已开展数百例肿瘤临床样本的生物3D打印微组织构建,经过大量实验研究及一致性验证,能够构建与患者组织高度一致的肿瘤微组织用于药敏检测,涵盖癌种包括肺癌、结直肠癌、脑胶质瘤、神经母细胞瘤、肝母细胞瘤、膀胱癌等高发癌种、难治肿瘤、儿童肿瘤,成功率>90%,可实现1-2周内完成采样至完成药敏检测流程。


生物3D打印技术,是一项前沿生物制造技术,能够用于制造例如类器官、器官芯片等具有不同尺寸规格、复杂程度的体外3D细胞组织模型。结合与人体组织高度相似的仿生生物材料及患者细胞,可以精确地复制患者肿瘤组织的细胞及细胞外基质特征。通过生物3D打印建立的肿瘤微组织与患者肿瘤组织中突变基因及突变类型保持高度一致。作为一项工程技术,能够更高效率、批量化地建立高重现性、高精度的模型。这些优势都使得生物3D打印技术在肿瘤精准医疗研究和临床应用中具有巨大的潜力。
生物3D打印构建流程
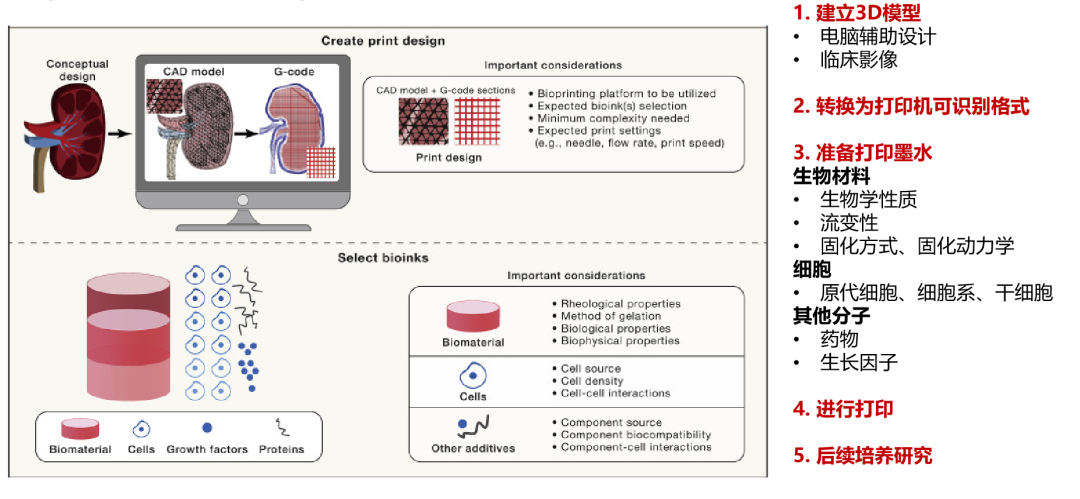
通过生物3D打印建立的肿瘤微组织,可以为患者提供个体化的治疗方案药物敏感性检测,包括类器官可检测的化疗药物、靶向药物。同时,在多种癌种,包括肺癌、结直肠癌等癌种中,生物3D打印为组织中可检测出较高比例免疫细胞,同时由于生物3D打印可以进行不同细胞组合的微组织模型制作,因此也可进行免疫治疗药物的检测,更好地满足患者的需求。
光固化生物3D打印后细胞存活率高、
并维持在体特性
如选择通过生物3D打印技术建立肿瘤微组织,大部分注意事项可参考专家共识针对肿瘤类器官的注意事项,此外运输时间方面相对类器官较为宽裕。目前样本质量、体积达标的情况下,在24小时内送达,均可实现>90%的构建成功率。
生物3D打印作为一种生物制造技术平台即将迭代为一种重要的生命科学工具,利用工程技术构建和模拟人体组织微环境,可涵盖包括类器官、器官芯片等3D模型的制造,从而代替动物实验。在药物研发临床前研究与评价的应用日趋明朗。
✦ ✦✦ ✦✦ ✦✦ ✦
关注我们获取更多咨询

✦ ✦ ✦ ✦ ✦ ✦ ✦ ✦
部分图片文字来自网络,若有侵权,请联系删除。
生物智造创建美好生活
Intelligent Biomanufacturing Creates Better Life
产品
科研服务
走进赛箔
资源中心
联系我们

