《Cell》:外周血淋巴细胞和肿瘤类器官共培养产生肿瘤反应性T细胞
生 物 智 造 创 建 美 好 生 活
Intelligent Biomanufacturing Creates Better Life
针对免疫检查点(如CTLA-4和PD-1/PD-L1)的抗体对晚期癌症患者有明显的临床益处。然而,有很大一部分患者对目前的免疫疗法没有反应。治疗失败的原因包括免疫原性抗原数量少、抗原表达缺陷和/或缺少替代性免疫检查点分子的表达。鉴于癌症的免疫规避机制种类繁多,目前需要解决的问题包括预测患者是否对免疫疗法敏感,什么机制可能是耐药性的基础,以及什么替代疗法可能克服耐药性。上皮癌的免疫疗法在临床上的广泛发展和使用使得剖析上皮癌中T细胞介导的肿瘤识别至关重要。来自荷兰癌症研究所Emile Voest团队的Krijn K. Dijkstra等建立了一个以个性化的方式诱导和分析肿瘤特异性T细胞对上皮癌反应的模型。作者证明,自体肿瘤类器官和外周血淋巴细胞的共同培养,可以从有错配修复缺陷的结直肠癌和非小细胞肺癌的患者的外周血中,扩增肿瘤反应性T细胞。此外,作者证明这些T细胞可用于评估杀死匹配的肿瘤类器官效率。这个模型为分离肿瘤反应性T细胞提供了一个无偏见的策略,并可用来评估在个体患者中,肿瘤细胞对T细胞介导的攻击的敏感性。
01
对有错配修复缺陷(dMMR)的结
直肠癌(CRC)类器官的特征分析
类器官在形态上反映了它们源于的原始肿瘤(图1A)。肿瘤类器官的WES显示了高突变负担,符合在先前报告的高突变CRC的特征(图1B)。考虑到MHCⅠ类的丧失在高达60%的dMMR CRC中发生,作者筛选了用IFN- γ刺激后的MHCⅠ类表达,并从62%的类器官样本中发现了9个MHCⅠ类缺陷的肿瘤类器官(图1D)。
02
通过与自体肿瘤类器官共培养
诱导循环T细胞的肿瘤反应性
接触IFN-γ也导致了PD-L1的诱导,PD-L1是T细胞激活的负调控因子(图1E),作者加入了PD-1的阻断抗体来抵消T细胞激活期间PD-L1的任何抑制作用。
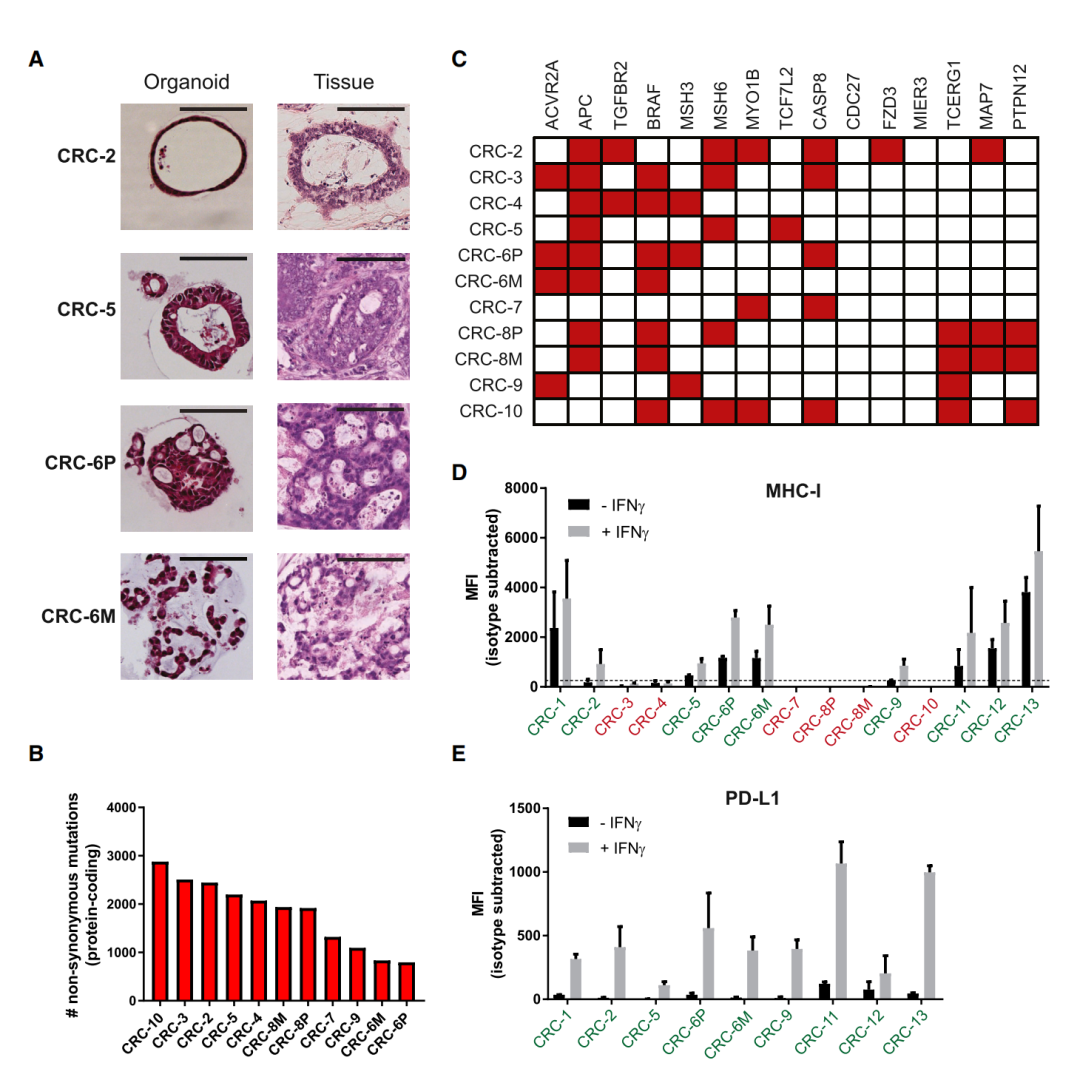
图1:dMMR CRC类器官的特征分析
在8名拥有MHC I类+肿瘤类器官的患者中,有4名在共培养2周后,用自体肿瘤类器官的刺激同时诱导了IFN-γ的分泌和CD107a的上调(图2B和2C)。来自CRC-9患者的CD8+T细胞的很大一部分已经具有肿瘤反应性,并且在共培养2周后,这一群体的频率增加了约10倍(图2D和2E)。相反,来自CRC-11、CRC-12和CRC-13患者的T细胞在类器官共培养前没有显示出任何可检测到的肿瘤反应性(图2E),表明T细胞类器官共培养系统也可用于扩大以前检测不到的肿瘤反应性T细胞群。
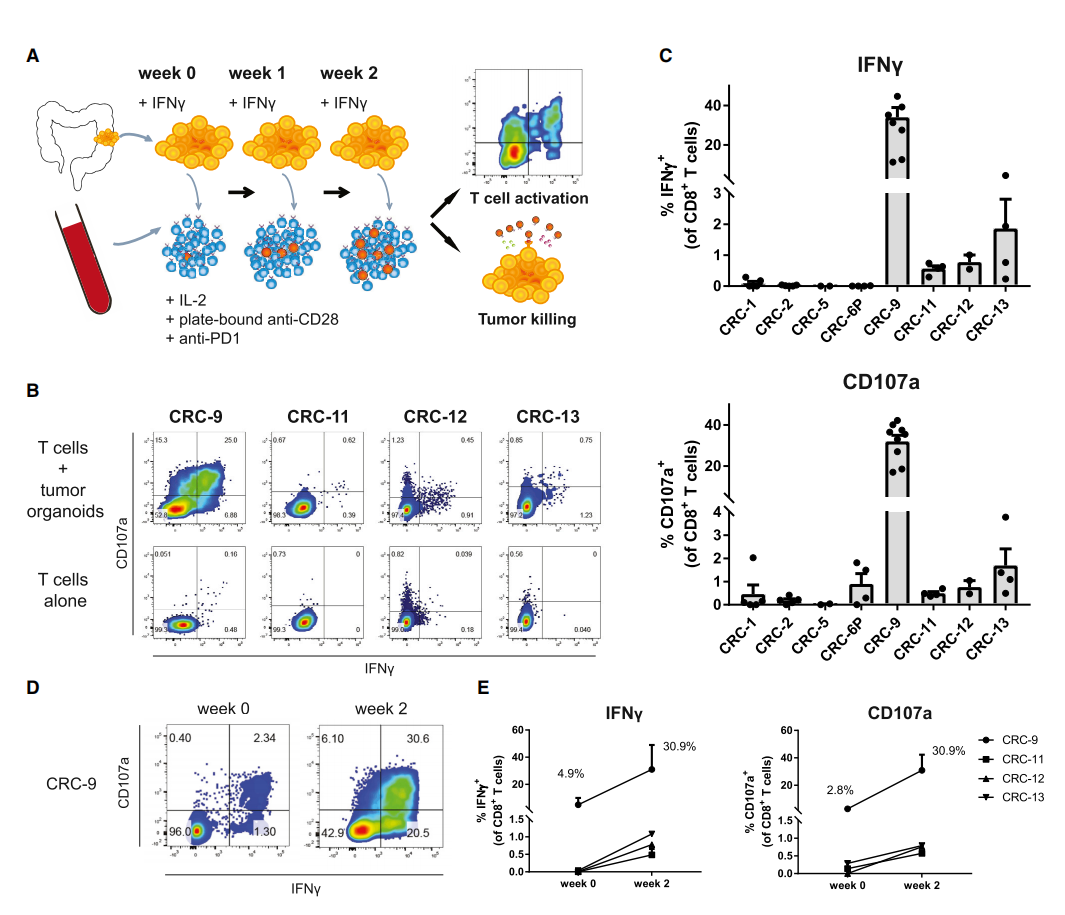
图2:通过与自体肿瘤类器官共培养
诱导循环T细胞的肿瘤反应性
03
诱导非小细胞肺癌(NSCLC)
患者循环T细胞的肿瘤反应性
作者从6名患者中生成了NSCLC类器官(图3A)。所有的NSCLC类器官都具有MHC I类功能,并在IFN-γ的刺激下表达不同水平的PD-L1(图3B和3C)。在体外将外周血单核细胞(PBMCs)暴露于自体肿瘤类器官中共培养2周后,两名患者的肿瘤反应性CD8+群体扩大(图3D和3E)。在与类器官共培养之前,这些反应都不能被持续检测到(图3F)。
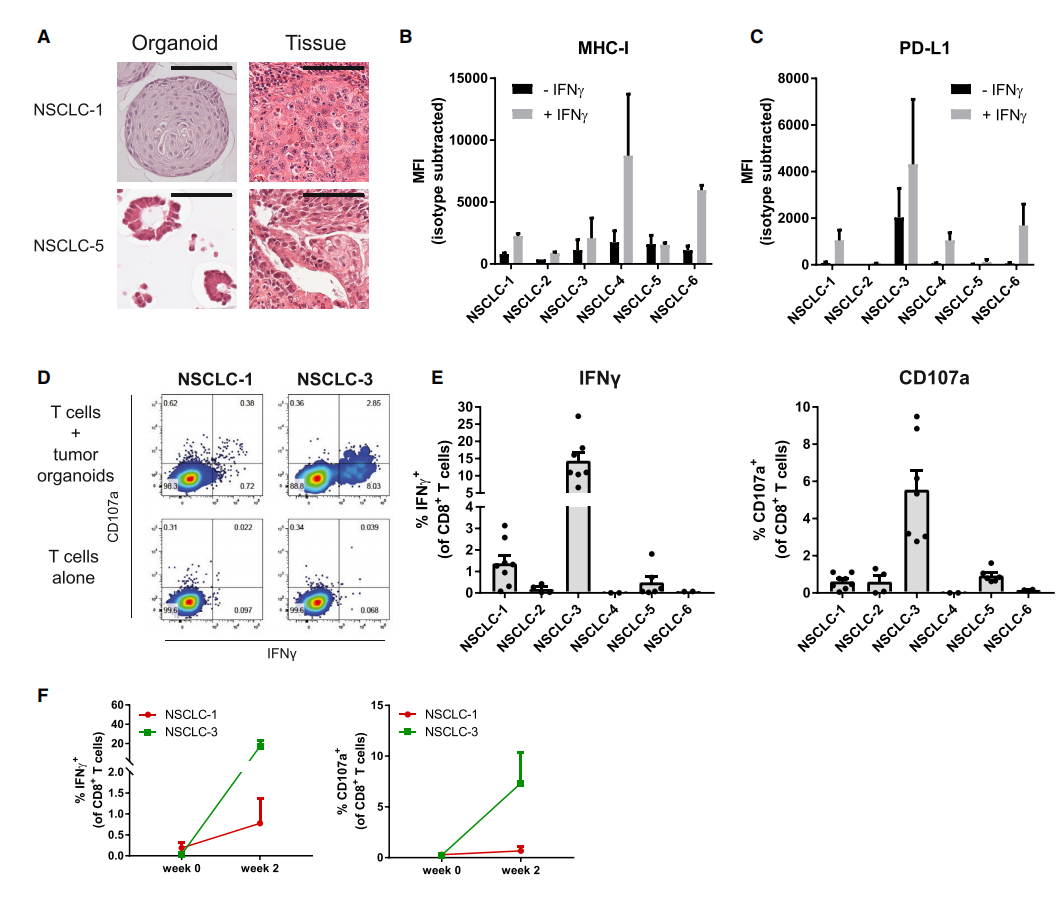
图3:诱导NSCLC患者的循环T细胞对肿瘤的反应性
04
类器官反应性T细胞的特异性
为了评估肿瘤类器官反应性T细胞对IFN-γ的依赖性,作者比较了用IFN-γ预刺激或不处理的肿瘤类器官刺激后的T细胞对活化标志物CD137的表达(图4A)。T细胞反应性仅存在于与外周血淋巴细胞共培养2周后诱发反应性的肿瘤类器官中;正常组织或pMMR CRC类器官中没有观察到T细胞反应性(图4B-4G)。
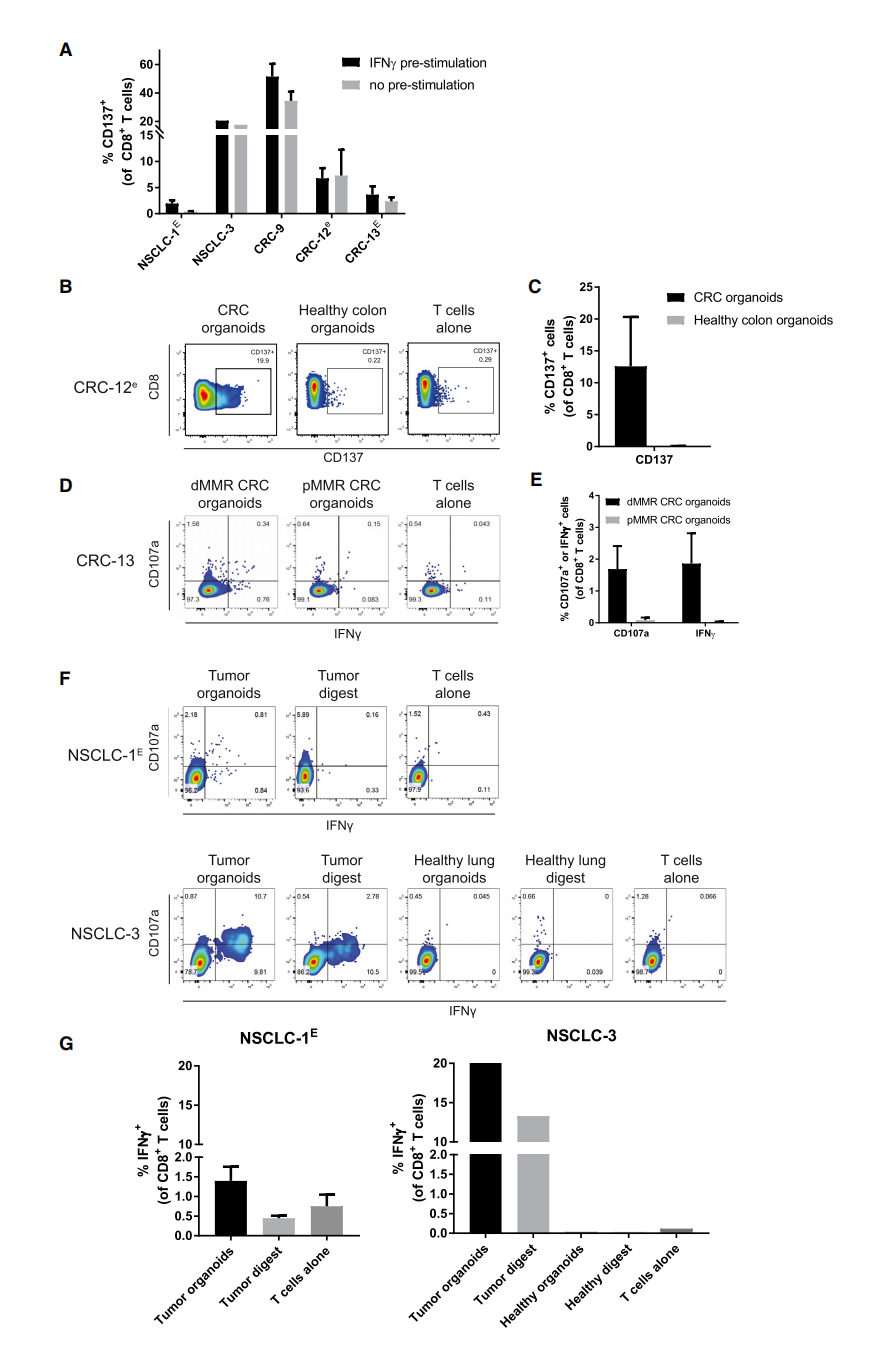
图4:类器官反应性T细胞的特异性
05
CD4+ T细胞对异种组织
培养成分的反应性
CD4+ T细胞的反应性并不局限于肿瘤类器官,在某些情况下,也对对照类器官(正常组织的类器官或来自CRC-13患者的同步pMMR CRC的类器官)有反应(图5B)。

图5:CD4+ T细胞对异种组织培养成分的反应性
06
肿瘤类器官被自体肿瘤
反应性T细胞所杀死
对于所有测试的样品,暴露于自体T细胞的肿瘤类器官存活率显著降低(图6A)。T细胞有效地杀死了肿瘤类器官,但不影响健康类器官的生存(图6C)。
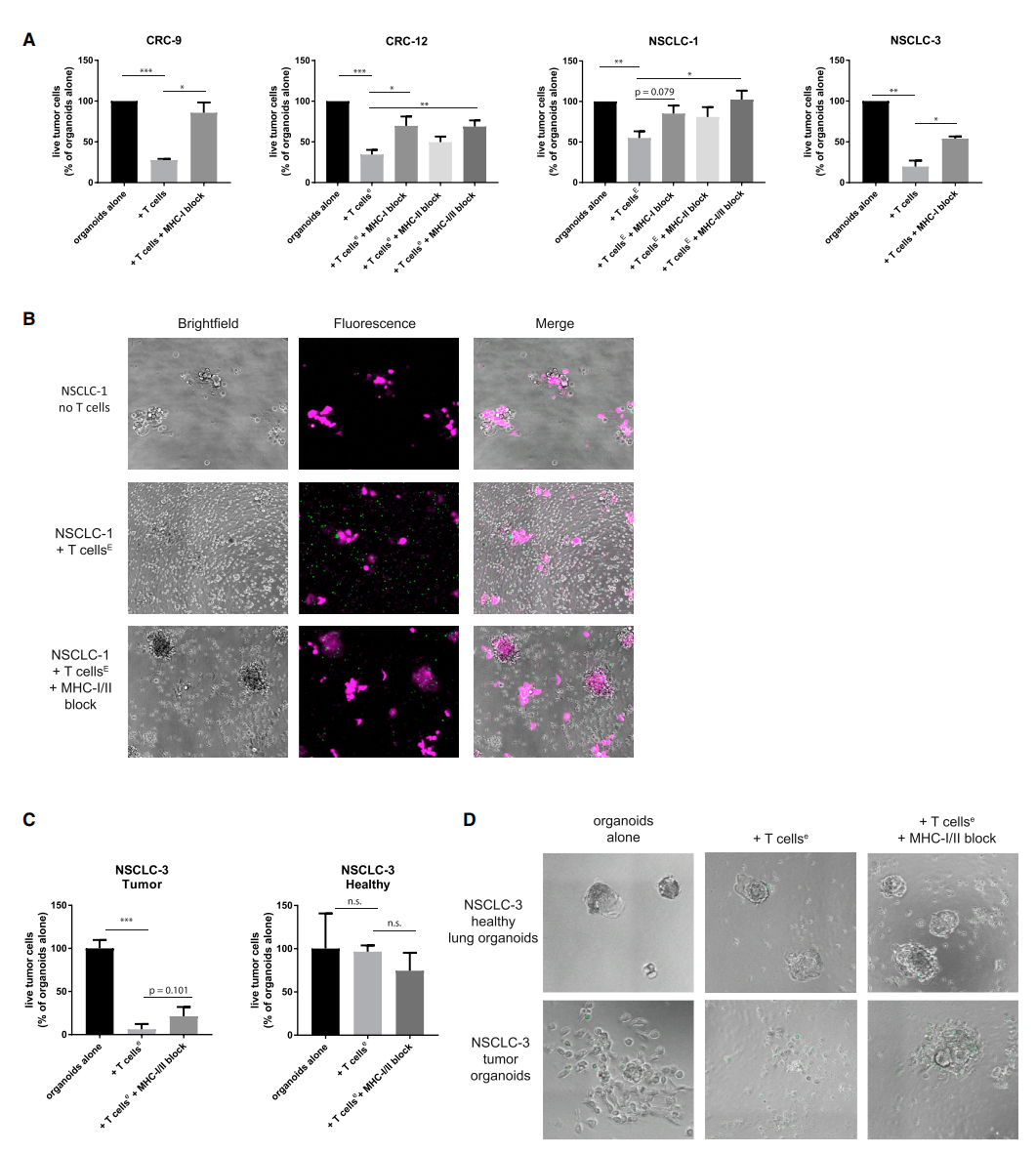
图6:肿瘤类器官被自体肿瘤反应性T细胞所杀死
结论
鉴于人类白细胞抗原(HLA)和T细胞受体(TCR)基因的多样性,人类癌症中表达的新抗原的私密性,以及T细胞介导的肿瘤破坏的多因素性,患者特异性模型系统的价值在免疫肿瘤学领域将会更高。本文中,作者证明肿瘤类器官可以用来建立个体化的体外模型系统,以支持基于T细胞的治疗,并研究T细胞和肿瘤细胞之间的相互作用。本文中的模型有两个主要的应用:1. 提供从机制上剖析决定肿瘤细胞对免疫疗法的敏感性和抗性的途径;2. 为以无偏见的方式产生患者特异性T细胞产品提供了可能性。对于最初对免疫检查点抑制剂治疗有反应但最终复发的患者,应在复发前后建立基于配对(肿瘤和血液)活检的联合培养以提供一个独特的检测系统,用于对复发的根本原因进行功能剖析。本文中的模型还可以通过与肿瘤类器官共培养来扩增循环肿瘤反应性T细胞,为产生患者用于过继性T细胞疗的特异性T细胞产品提供了一个临床上可行的策略。本文中,作者专注于具有高突变负荷的肿瘤类型,未来研究中,需要确定诱导肿瘤反应性T细胞的可行性是否可以扩展到免疫原性差的癌症,如错配修复缺陷的CRC。未来的研究可以集中通过在改善循环肿瘤反应性T细胞的选择策略上,例如基于T细胞的PD-1表达,来提高成功率。
原文出处:
https://doi.org/10.1016/j.cell.2018.07.009
关于赛箔生物
赛箔生物致力于开发生物3D打印、生物材料、体外检测组织产品、再生器官产品,并且基于相关产品开发精准的检测评价方法及服务。目前已开展数百例肿瘤临床样本的生物3D打印微组织构建,经过大量实验研究及一致性验证,能够构建与患者组织高度一致的肿瘤微组织用于药敏检测,涵盖癌种包括肺癌、结直肠癌、脑胶质瘤、神经母细胞瘤、肝母细胞瘤、膀胱癌等高发癌种、难治肿瘤、儿童肿瘤,成功率>90%,可实现1-2周内完成采样至完成药敏检测流程。


生物3D打印技术,是一项前沿生物制造技术,能够用于制造例如类器官、器官芯片等具有不同尺寸规格、复杂程度的体外3D细胞组织模型。结合与人体组织高度相似的仿生生物材料及患者细胞,可以精确地复制患者肿瘤组织的细胞及细胞外基质特征。通过生物3D打印建立的肿瘤微组织与患者肿瘤组织中突变基因及突变类型保持高度一致。作为一项工程技术,能够更高效率、批量化地建立高重现性、高精度的模型。这些优势都使得生物3D打印技术在肿瘤精准医疗研究和临床应用中具有巨大的潜力。
生物3D打印构建流程
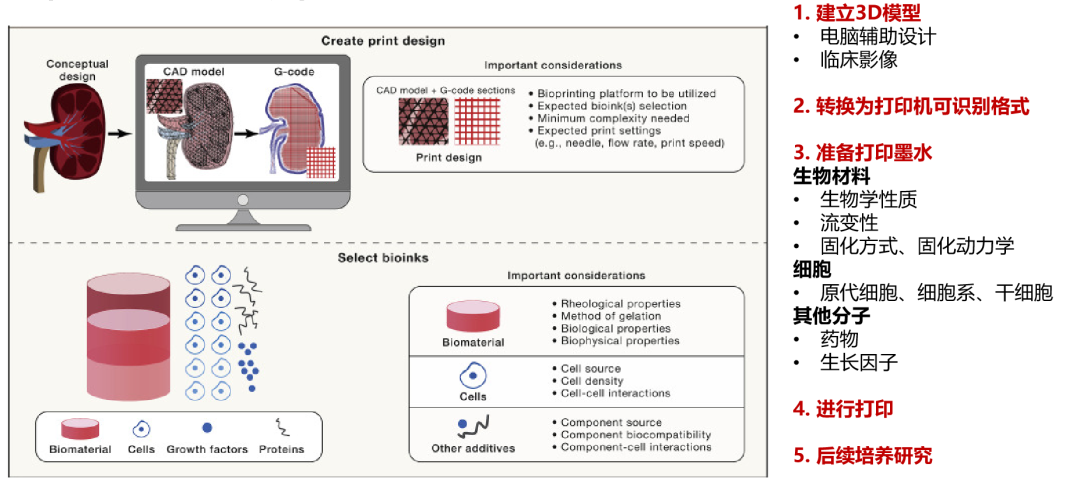
通过生物3D打印建立的肿瘤微组织,可以为患者提供个体化的治疗方案药物敏感性检测,包括类器官可检测的化疗药物、靶向药物。同时,在多种癌种,包括肺癌、结直肠癌等癌种中,生物3D打印为组织中可检测出较高比例免疫细胞,同时由于生物3D打印可以进行不同细胞组合的微组织模型制作,因此也可进行免疫治疗药物的检测,更好地满足患者的需求。
光固化生物3D打印后细胞存活率高、
并维持在体特性
如选择通过生物3D打印技术建立肿瘤微组织,大部分注意事项可参考专家共识针对肿瘤类器官的注意事项,此外运输时间方面相对类器官较为宽裕。目前样本质量、体积达标的情况下,在24小时内送达,均可实现>90%的构建成功率。
生物3D打印作为一种生物制造技术平台即将迭代为一种重要的生命科学工具,利用工程技术构建和模拟人体组织微环境,可涵盖包括类器官、器官芯片等3D模型的制造,从而代替动物实验。在药物研发临床前研究与评价的应用日趋明朗。
✦ ✦✦ ✦✦ ✦✦ ✦
关注我们获取更多咨询

✦ ✦ ✦ ✦ ✦ ✦ ✦ ✦
部分图片文字来自网络,若有侵权,请联系删除。
生物智造创建美好生活
Intelligent Biomanufacturing Creates Better Life
产品
科研服务
走进赛箔
资源中心
联系我们

