《Lab On a Chip》:人类肠道芯片模拟微生物菌群在肠道蠕动时的运动和流动

来自哈佛大学Donald E. Ingber团队的Hyun Jung Kim等作者开发了一种基于活细胞的体外肠道模型,模拟人类肠道的机械、结构、吸收、运输和病理生理特性,以及其关键的微生物共培养,可以加速药物开发,并有可能取代动物试验。本文描述的仿生 "人类肠道芯片 "微装置,由两个微流控通道组成,通道被涂有细胞外基质(ECM)的多孔柔性膜隔开,内衬是人类肠道上皮细胞(Caco-2),模拟了活体肠道的复杂结构和生理学。
通过在微通道上以低速率流动液体,产生低剪切应力,并施加周期性应力,模拟生理性蠕动,作者重建了肠道微环境。在这些条件下,柱状上皮细胞迅速分化,自发地生长成褶皱,再现了肠绒毛的结构,并形成了对小分子的高完整性屏障,比在静态Transwell模型中培养的细胞更好地模拟整个肠道。
此外,正常的肠道微生物(鼠李糖乳杆菌GG)可以成功地在培养的上皮细胞的管腔表面进行长时间(1周)的共培养,而不影响上皮细胞的活力,这与在人类中观察到的那样改善了屏障功能。因此,作者的肠道芯片再现了人类肠道的多种动态物理和功能特征,这些特征对其在一个可控的微流控环境中的功能至关重要,可用于运输、吸收和毒性研究,因此它对药物测试以及新型肠道疾病模型的开发具有重要价值。
1. 肠道芯片微系统设计
微系统设计包含了两层紧密相接的微流控通道,通道之间由一个薄的多孔膜隔开,膜上涂有细胞外基质(ECM),并且其内壁上覆盖有人类Caco-2肠上皮细胞(见图1a)。为了使上皮细胞单层产生类似于人类肠道蠕动所引起的有节奏的机械变形,由计算机控制的真空管道调节的循环吸力被施加到位于微通道两侧的全高空的真空室中,以反复拉伸和放松弹性的ECM涂层多孔膜(图1d)。
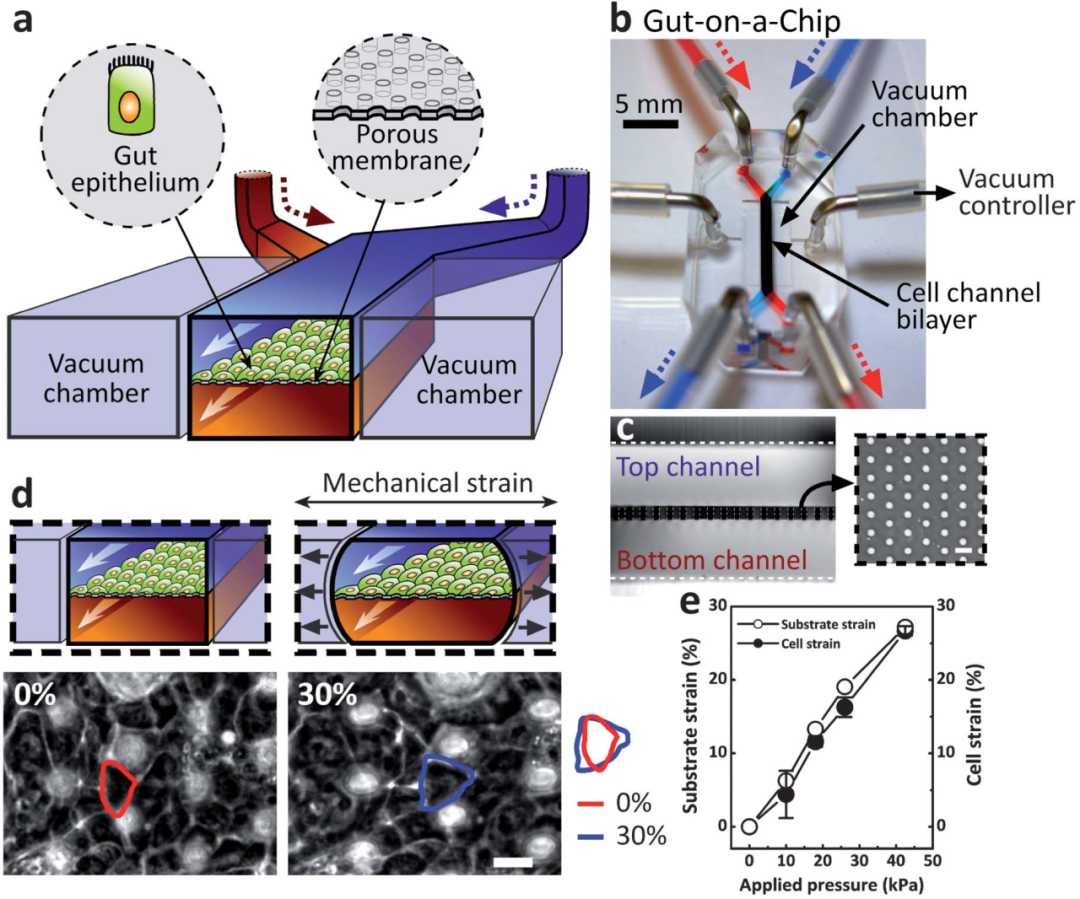
图1 芯片上的人类肠道
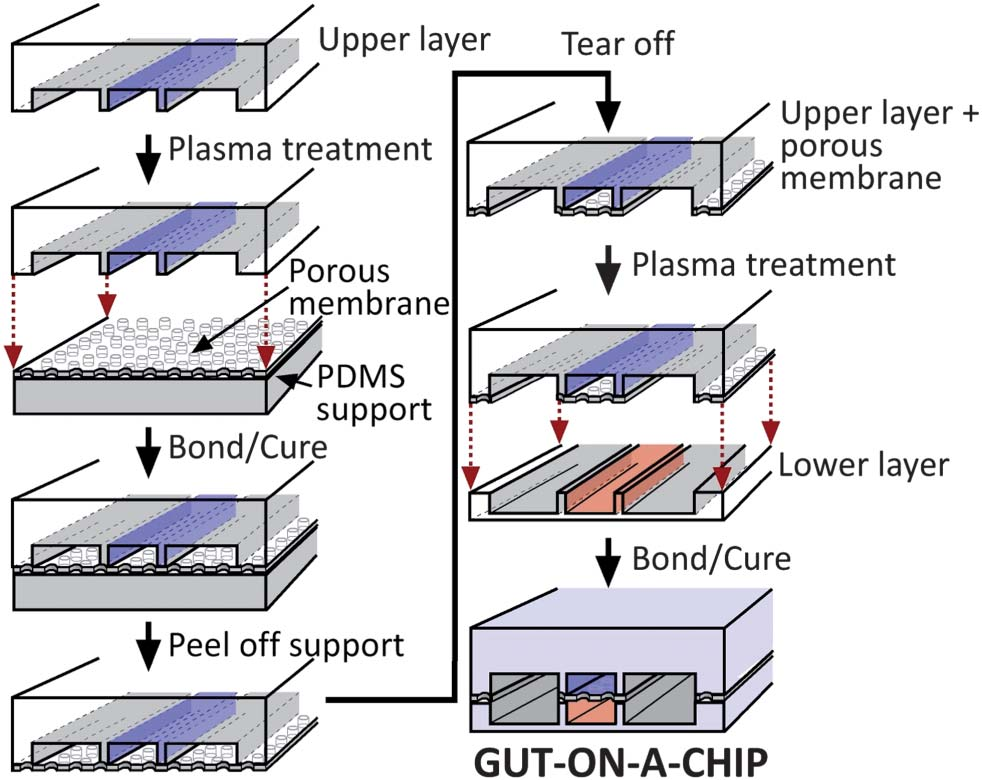
图2 微加工过程
2. 模拟肠道微环境对
上皮组织的影响
为了探索模拟肠道物理微环境的生理意义,Caco-2细胞在没有液体流动和机械应变的静态Transwell室(图3a)或在只有单独流动(图3b)或流动加循环机械应变(图3c)的肠道芯片微流控装置中生长。
共聚焦荧光显微镜对F-actin分布和核位置的分析显示,在Transwell中静态条件下生长的上皮细胞是高度扁平的,几乎是鳞片状的(图3a)。相比之下,在有或没有伴随循环应变的流体流速下生长的细胞在尺寸上几乎高了6倍(图3d),表现出具有基底核的极化上皮细胞形式(图3b,c)。
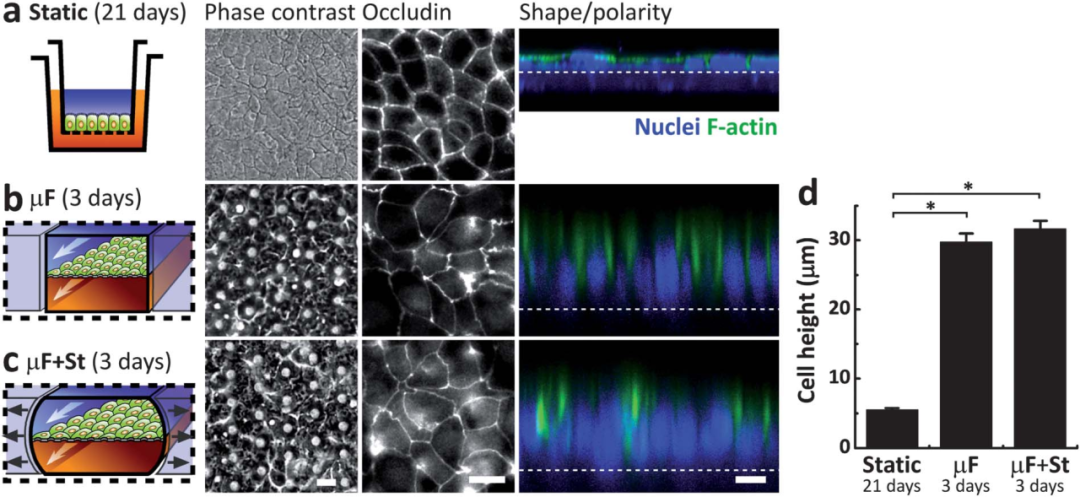
图3 在静态Transwell系统中培养了21天的Caco-2上皮细胞的形态学
当Caco-2细胞在有流动和循环应变的肠道芯片微装置中培养更长的时间时,作者发现原本平面的柱状上皮细胞自发地生长,形成起伏和褶皱(图4a)。当用免疫荧光共聚焦显微镜分析垂直切面时,发现这些褶皱呈现出正常肠绒毛的形态,其内衬是具有基底核的极化柱状上皮细胞,并由隐窝分隔(图4b)。
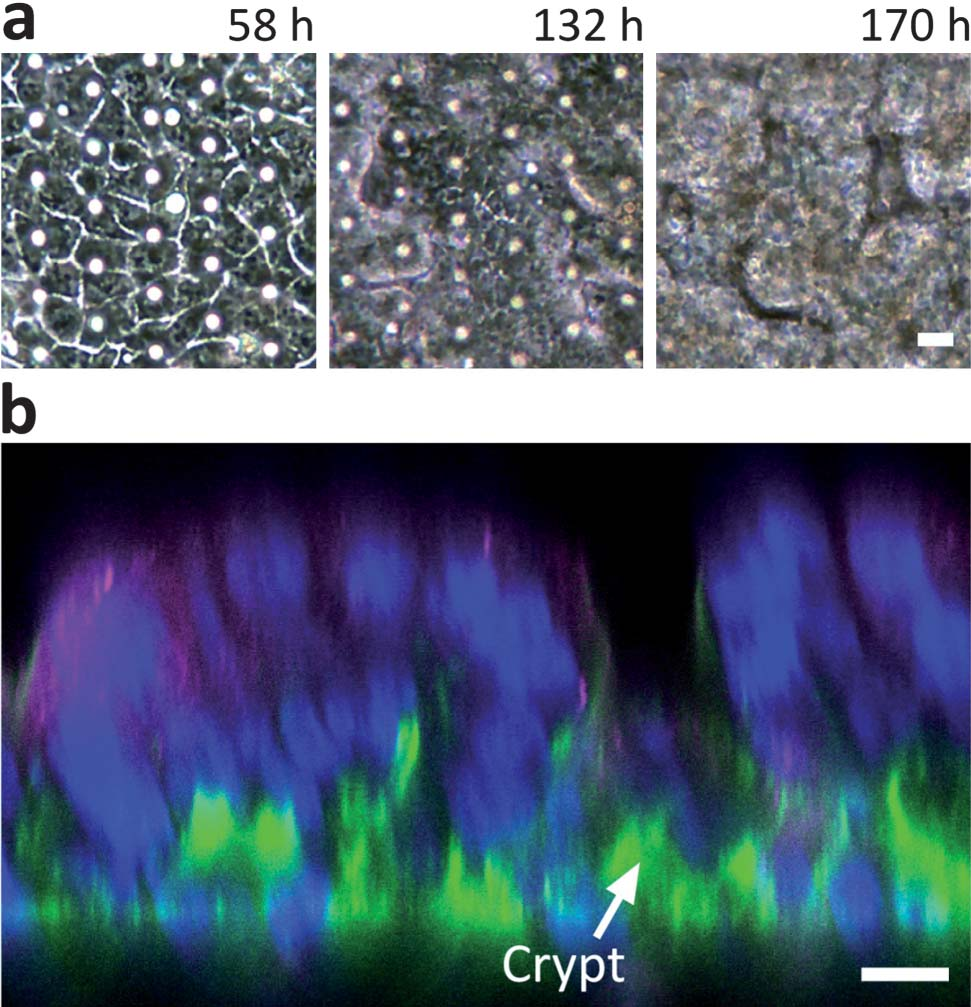
图4 在肠道芯片上培养的Caco-2细胞
自发形成的肠绒毛
3. 在体外重建肠道屏障功能
作者发现循环应变增加了细胞间的渗透性,而且是在不改变这些细胞单层的经皮层电阻(TEER)的条件下发生的(图5b,5a),这表明机械变形可能直接改变细胞间运输的机制。在静态Transwell系统中,培养5天的细胞与培养21天的细胞相比,Caco-2细胞分化增加了超过7倍(图5c)。
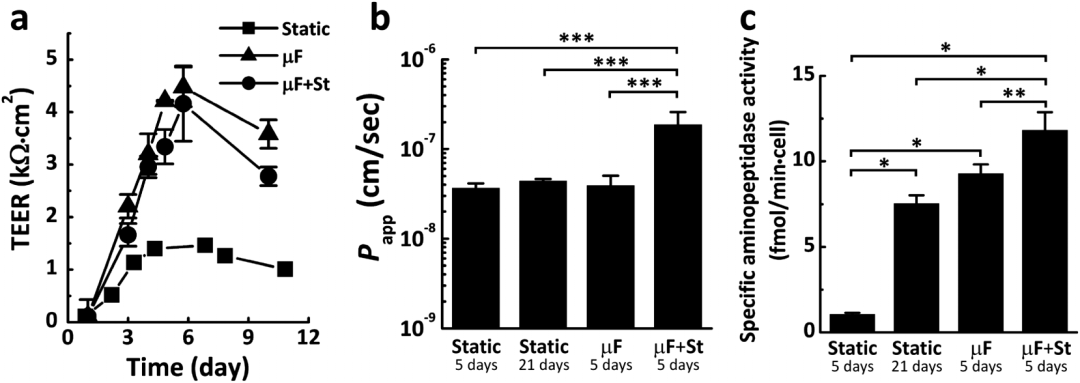
图5 在有或没有循环应变的情况下,评估在Transwell(静态)或微流控肠道芯片中培养的Caco-2单层的肠道屏障的功能和分化。
4. 宿主-微生物菌群共培养
使用连续流动和循环应变的微流控共培养96小时后,鼠李糖乳杆菌(LGG)细胞的微群仍然紧密地粘附在Caco-2单层的表面(图6a)。活/死染色证实,Caco-2上皮细胞在这些条件下与LGG共培养后仍然完全存活(图6b)。在这些共培养条件下,肠道细胞单层不仅能够保持正常的屏障功能,而且通过定量TEER测量的屏障完整性实际上随着时间的推移而改善(图6c)。相反,在静态Transwell系统中,TEER在共培养的第一天就消散了,48小时后,上皮单层死亡并完全脱离(图6c)。

图6 肠道芯片中人类肠道上皮单层上的
长期微生物共培养
结论
人类肠道芯片微装置提供了一个可控的微平台,在相关生理线索下(包括循环的机械应变、流体流动和微生物菌群的共存)研究关键的肠道功能。该装置重现了活的肠道中经历的低水平的液体流动和剪切应力,以促进肠道上皮细胞加速分化,形成三维绒毛状结构,并增加肠道屏障功能;加入模拟正常蠕动的循环机械应变则进一步增强了这些反应。在肠道芯片内分化的肠道上皮细胞可以支持正常生活在人类肠道内的微生物菌群的生长。因此,蠕动的人类肠道芯片可能有助于研究肠道功能的机械调节,以及宿主与微生物的共生和进化。鉴于它有效地再现了正常人类肠道的许多复杂功能,它也可能成为药物筛选和毒理学测试的一个重要平台。
原文出处:DOI: 10.1039/C2lc40074j
关于赛箔生物
赛箔生物致力于开发生物3D打印、生物材料、体外检测组织产品、再生器官产品,并且基于相关产品开发精准的检测评价方法及服务。目前已开展数百例肿瘤临床样本的生物3D打印微组织构建,经过大量实验研究及一致性验证,能够构建与患者组织高度一致的肿瘤微组织用于药敏检测,涵盖癌种包括肺癌、结直肠癌、脑胶质瘤、神经母细胞瘤、肝母细胞瘤、膀胱癌等高发癌种、难治肿瘤、儿童肿瘤,成功率>90%,可实现1-2周内完成采样至完成药敏检测流程。


生物3D打印技术,是一项前沿生物制造技术,能够用于制造例如类器官、器官芯片等具有不同尺寸规格、复杂程度的体外3D细胞组织模型。结合与人体组织高度相似的仿生生物材料及患者细胞,可以精确地复制患者肿瘤组织的细胞及细胞外基质特征。通过生物3D打印建立的肿瘤微组织与患者肿瘤组织中突变基因及突变类型保持高度一致。作为一项工程技术,能够更高效率、批量化地建立高重现性、高精度的模型。这些优势都使得生物3D打印技术在肿瘤精准医疗研究和临床应用中具有巨大的潜力。
生物3D打印构建流程
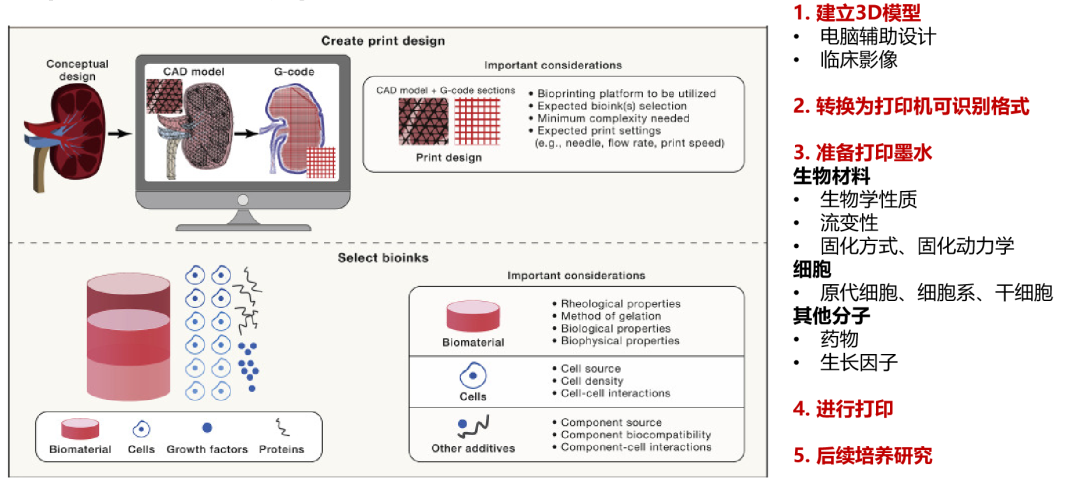
通过生物3D打印建立的肿瘤微组织,可以为患者提供个体化的治疗方案药物敏感性检测,包括类器官可检测的化疗药物、靶向药物。同时,在多种癌种,包括肺癌、结直肠癌等癌种中,生物3D打印为组织中可检测出较高比例免疫细胞,同时由于生物3D打印可以进行不同细胞组合的微组织模型制作,因此也可进行免疫治疗药物的检测,更好地满足患者的需求。
光固化生物3D打印后细胞存活率高、
并维持在体特性
如选择通过生物3D打印技术建立肿瘤微组织,大部分注意事项可参考专家共识针对肿瘤类器官的注意事项,此外运输时间方面相对类器官较为宽裕。目前样本质量、体积达标的情况下,在24小时内送达,均可实现>90%的构建成功率。
生物3D打印作为一种生物制造技术平台即将迭代为一种重要的生命科学工具,利用工程技术构建和模拟人体组织微环境,可涵盖包括类器官、器官芯片等3D模型的制造,从而代替动物实验。在药物研发临床前研究与评价的应用日趋明朗。
✦ ✦✦ ✦✦ ✦✦ ✦
关注我们获取更多咨询

✦ ✦ ✦ ✦ ✦ ✦ ✦ ✦
部分图片文字来自网络,若有侵权,请联系删除。

