《Advanced Science》:3D生物打印神经母细胞瘤模型再现肿瘤细胞与内皮细胞动态相互作用

1
简介
神经母细胞瘤(NB)是儿童最常见的颅外肿瘤,发病率和死亡率高,目前缺乏可靠的生物模拟实验模型来深入了解NB的肿瘤微环境(TME)。来自埃默里大学医学院Kelly C. Goldsmith和Vahid Serpooshan团队的Liqun Ning等作者利用3D生物打印的方法,结合NB球状体,创建了一个NB的体外血管模型,以探索内皮化微环境中的肿瘤功能。作者采用了甲基丙烯酰明胶(GelMA)生物墨水来建立具有高保真度和机械可调性的多通道立方体肿瘤模拟物。人源性NB球状体和人脐静脉内皮细胞(HUVECs)被包裹在GelMA内,并在静态和动态条件下进行共培养,显示出高水平的存活和生长。NB-EC整合和肿瘤细胞迁移的数据表明,当NB在生物打印的内皮化模型中,与HUVECs共培养和动态培养时,NB的恶性程度增加。这个模型还可评估不同TME条件下NB球状体的代谢、细胞因子和基因表达情况。这些结果建立了一个高通量的研究平台,以研究TME介导的肿瘤生长、侵袭和治疗反应的细胞分子机制。
2
实验结果
本研究中,作者利用3D嵌入式生物打印方法,将NB球状体和HUVECs打印在预定的血管组织几何形状中,用于研究NB肿瘤的进展和与内皮的相互作用(图1)。
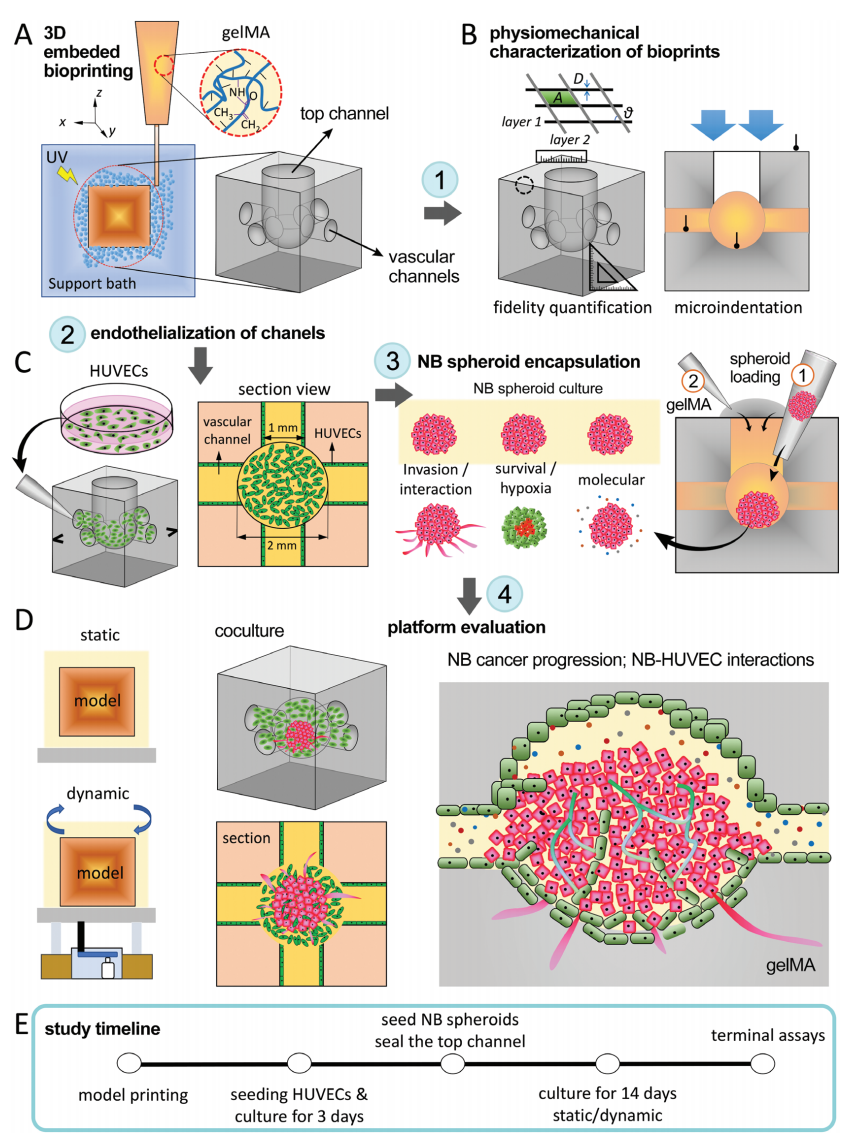
图1. 研究工作流程示意图
使用经过调整的Carbopol支撑液和GelMA墨水,生物打印的GelMA模型有足够的结构保真度(图2)。由于Carbopol支撑液为打印的非交联结构提供了支持,嵌入式生物打印方法允许每次运行创建多个立方体模型(图2D),显示了这种技术在高通量组织制造方面的巨大潜力。结果表明,打印的立方体的边长、顶部通道的直径和顶部通道的圆度有高度的一致性(图2E,F)。通过控制恒定强度的紫外线曝光时间,生物打印的GelMA组织的硬度能够被准确控制(图2G)。显微压痕结果证实,模型中存在硬度梯度,与血管通道和中央空腔相比,顶部/底部表面较硬(图2G)。
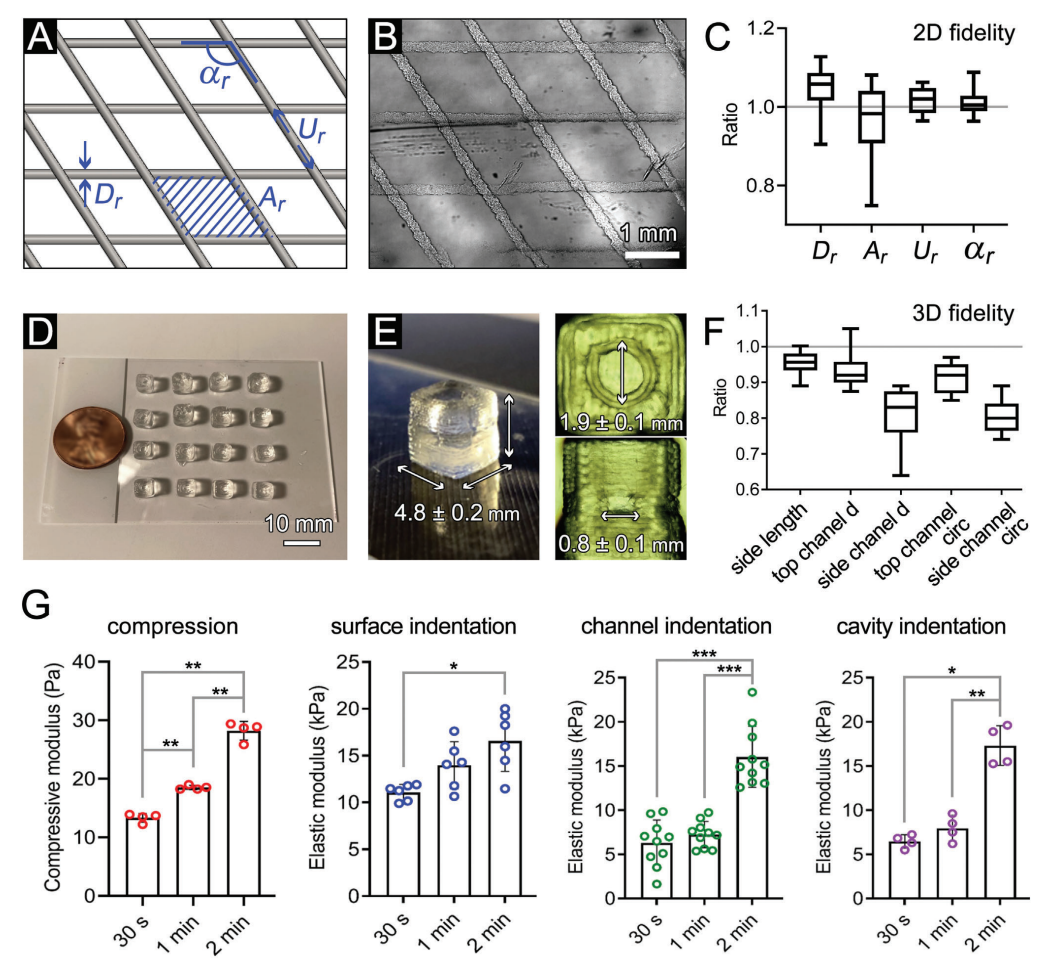
图2. 打印保真度和生物打印的GelMA模型的机械性能特征
NB神经球状体的原位明场成像显示,在2周的培养过程中,无论是对照组(悬浮在NB培养基中的NB球状体)还是被生物打印GelMA包裹的球状体,其大小都有明显增长(图3A-C)。活/死检测显示,在2周的培养过程中,对照组和打印的GelMA立方体中的细胞存活率没有明显差异(图3B,C)。数据还表明,在悬浮液和生物打印包裹的NB球状体中都形成了尺寸驱动的缺氧中心区域(图3C),这已被证明在实体瘤的血管生成、侵袭、转移和对治疗的反应中起着关键作用。IHC分析显示了生长中的球状体与GelMA基质的结合,以及球状体中缺氧核心的形成(图3D,F,G)。明场和共聚焦图像也显示了NB球状体和GelMA之间的部分交界,NB细胞有一些有限的突起到3D基质中(图3F,G)。

图3. NB球状体的存活、生长以及与生物打印的GelMA结构中的3D基质的相互作用
HUVECs在3D结构的不同区域表现出高水平的活力(图4A-C)。AlamarBlue在培养期间持续减少,这表明生物图谱内的HUVECs的活力/增殖增加(图4D)。IHC分析表明,在第14天,GelMA结构的打印通道和中心腔成功实现了内皮化,HUVECs表达CD31和CX43(图4B)。HUVECs从通道的管腔表面渗入到GelMA基质中(图4B),进一步证实了GelMA能保持EC功能的生物活性。CD31的表达水平在第14天明显增加,表明在GelMA生物打印中,ECs的持续增长和细胞功能的增强(图4E)。
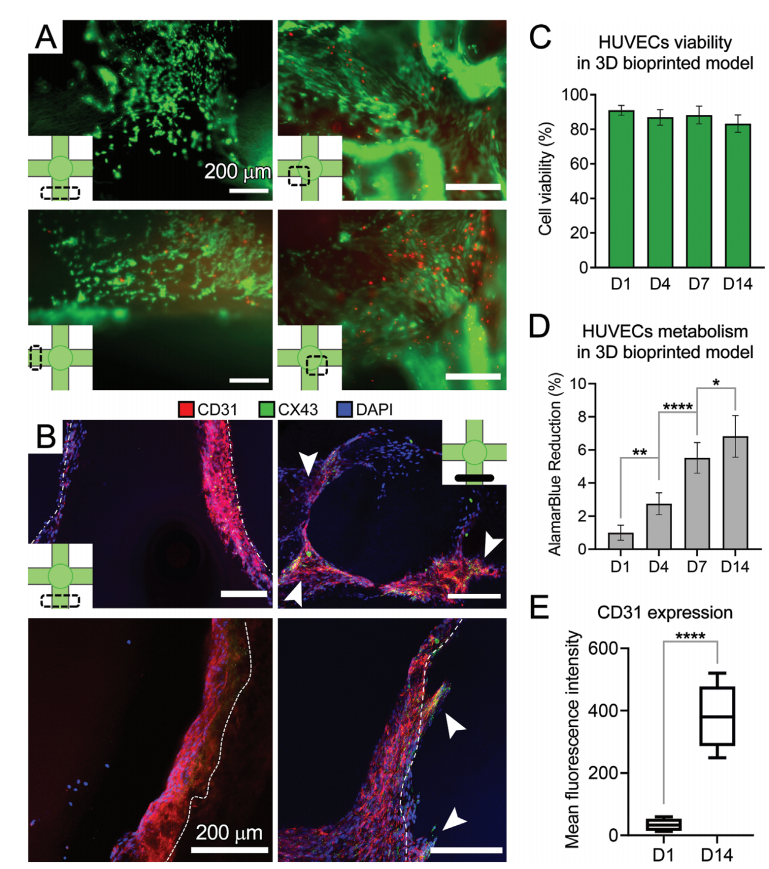
图4. 评估HUVECs在3D生物打印的GelMA通道内的存活和生长
静态培养的NB-EC模型中球状体直径和周长持续增加,这与在培养基(对照组)或在没有HUVECs(纯NB,图5B)的结构中培养的球状体没有明显区别。考虑到三组中使用了一致的培养基成分,可以得出结论,ECs的加入并没有阻止NB的生长,但可能将球状体变成不对称的形状(图5B)。IHC分析证实,与单独培养的NB相比,生物打印共培养的NB细胞的迁移性和侵袭性更强(图3D-F)。共培养的NB在NB特异性突触蛋白的表达上没有明显的差异,这表明ECs没有引起负面影响(图5F)。NB细胞与HUVECs的共培养也明显增加了癌细胞对GelMA基质的侵袭程度(图5I)。
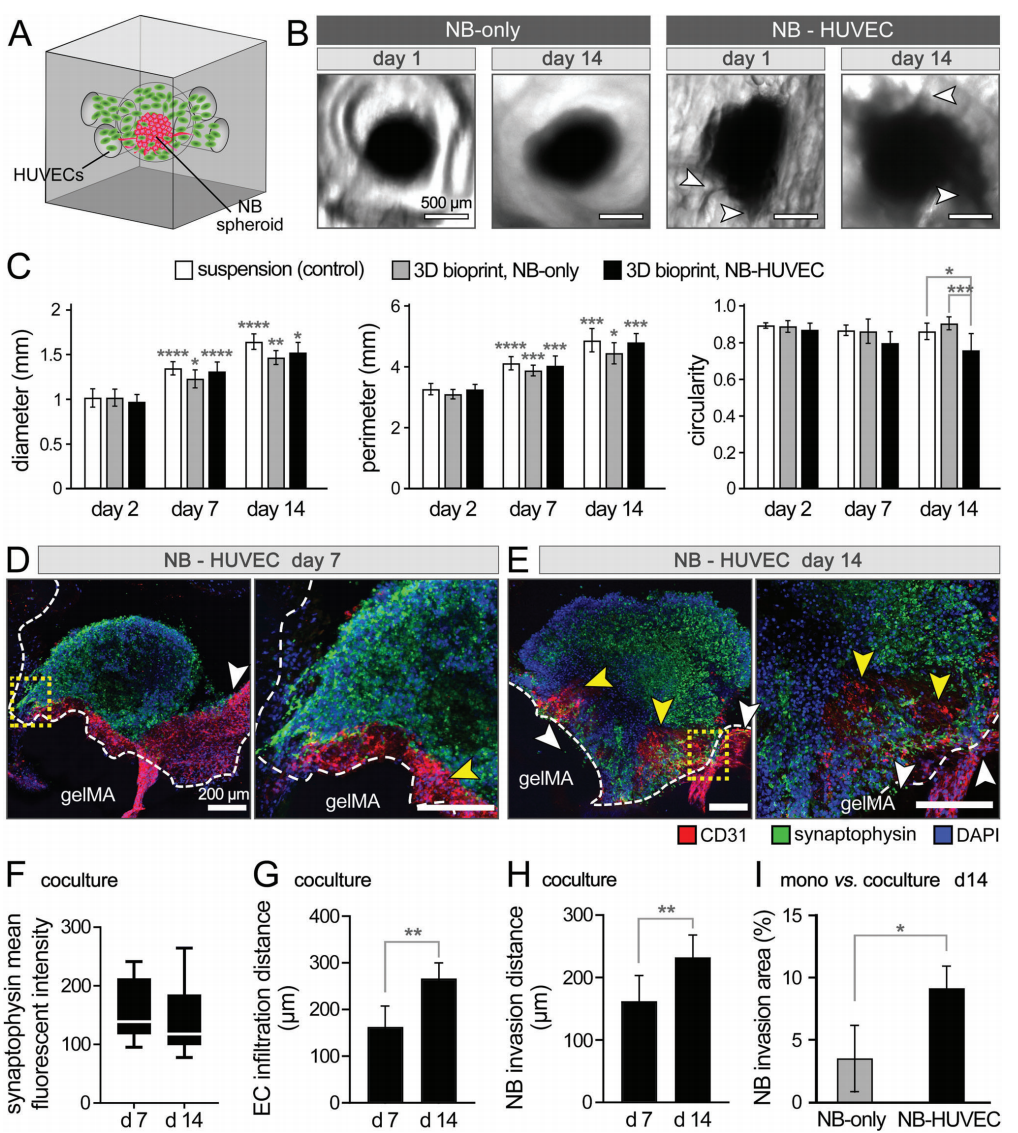
图5. NB-HUVEC在3D生物打印GelMA结构中的共培养
作者使用速度可控的旋转摇杆对装载NB-HUVEC的GelMA生物打印结构进行灌注,以模拟动态血管灌注14天(图6A)。NB球状体的直径、周长和圆度显示出一致的大小和形态。(图6B,C)。共培养组的圆形度降低,与静态(非灌注)培养的结果一致(图5B,C),表明ECs的加入,加上流动,可能促进NB细胞向GelMA基质的各向异性迁移(入侵)。对共培养组的IHC分析显示,HUVECs和NB细胞向相反的区域有明显的浸润(图6D,E)。动态培养使得两种细胞类型的迁移行为有增加趋势(图6F-I)。
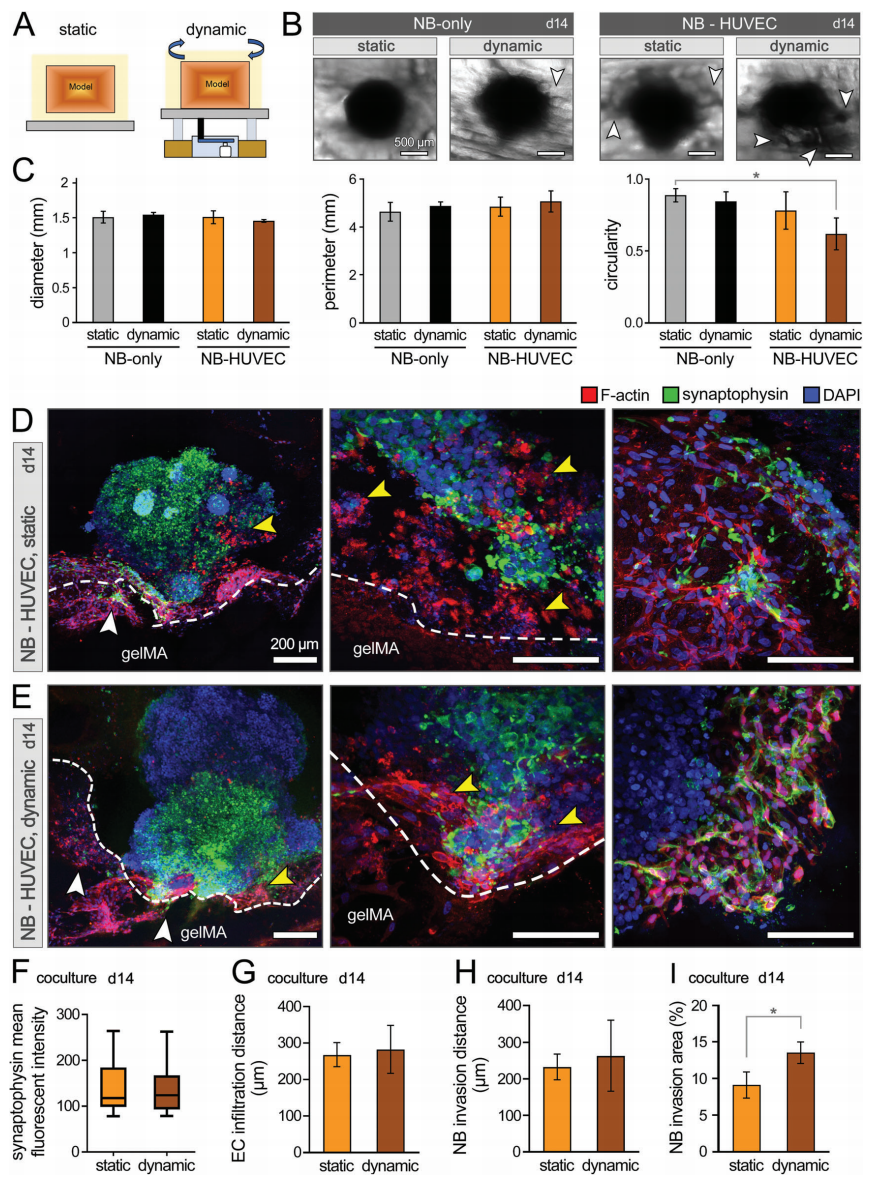
图6. 在静态和动态条件下,NB球状体与HUVECs在3D生物打印模型中进行共培养
对上清液(培养基)进行的纵向生物分析显示,与纯NB组(悬浮对照组和立方体中的球状体)相比,NB-HUVEC结构在静态和动态培养中都表现出明显较高的营养代谢物消耗水平,同时伴有代谢物的产生和积累,并与基线培养基成正比(图7A)。不同研究组培养液上清显示出有明显差异的细胞因子水平。比较静态与动态的生物打印的纯NB(图7B),显示动态培养中ANG-1、Angiostatin、CXCL16、Follistatin、G-CSF、IL-1b、IL-4、IL-12p70、MCP-4和TGFa的显著上调。静态的纯NB组比较 NB-HUVEC组(图7B)显示出大多数血管生成细胞因子在共培养组中的急剧上调。与动态培养组和其他研究组相比,静态培养组显示了血管生成标记物的最高水平,(图7B)。

图7. 3D生物打印的体外NB模型的代谢、血管生成和基因表达谱分析
3
结论和未来工作
大量研究工作证实,癌细胞和血管内皮之间的相互作用在重塑TME和癌症转移中是不可缺少的。可灌注的血管通道对于模拟动态的TME或生理上相关的固体肿瘤的大小和密度是至关重要的。
本研究介绍了一种先进的生物打印方法,基于GelMA生物墨水和Carbopol支撑液的优化特性,以及对生物打印参数的严格调节。这种方法使血管肿瘤模型的生物制造具有较高的结构保真度和可重复性,为直接加入NB球状体、内皮细胞和其他TME成分提供了一个高度可调控的微环境。
本文证明了生物打印血管模型在动态培养条件下保持NB肿瘤活力、生长、侵袭以及与内皮细胞相互作用的可行性。在GelMA结构中单独培养的NB球状体和ECs表现出较高的生存能力,并保持其功能。当共培养时,NB-HUVECs表现出更强的细胞-细胞相互作用,NB细胞向GelMA组织迁移/侵犯,EC向肿瘤的缺氧区域浸润。代谢、细胞因子和基因表达分析表明,在动态条件下的NB-EC共培养模型最有效地反映了肿瘤细胞和血管之间的相互作用。
未来的研究可以利用这个生物工程平台来全面研究NB(和其他)肿瘤的生物特性,以应对TME参数的时空变化,如免疫和基质细胞、缺氧、血管生成、ECM硬度和组成。未来模型可结合NB TME的免疫和基质细胞成分,研究NB对用于治疗高风险患者的免疫疗法的反应。NB的灌注体外模型将能够模拟各种化疗、免疫疗法,甚至是细胞疗法的组合,以确定对这些疗法的抗性机制的特征和目标。
在生物打印的内皮化通道内实施与生理相关的血管流动方案,可以在控制肿瘤血流决定因素的同时进行深入的机制研究。此外,通过直接将从患者身上提取的肿瘤组织纳入生物打印模型,可能有机会利用该平台进行体外研究。
原文:DOI: 10.1002/advs.202200244
关于赛箔生物
赛箔生物致力于开发生物3D打印、生物材料、体外检测组织产品、再生器官产品,并且基于相关产品开发精准的检测评价方法及服务。目前已开展数百例肿瘤临床样本的生物3D打印微组织构建,经过大量实验研究及一致性验证,能够构建与患者组织高度一致的肿瘤微组织用于药敏检测,涵盖癌种包括肺癌、结直肠癌、脑胶质瘤、神经母细胞瘤、肝母细胞瘤、膀胱癌等高发癌种、难治肿瘤、儿童肿瘤,成功率>90%,可实现1-2周内完成采样至完成药敏检测流程。


生物3D打印技术,是一项前沿生物制造技术,能够用于制造例如类器官、器官芯片等具有不同尺寸规格、复杂程度的体外3D细胞组织模型。结合与人体组织高度相似的仿生生物材料及患者细胞,可以精确地复制患者肿瘤组织的细胞及细胞外基质特征。通过生物3D打印建立的肿瘤微组织与患者肿瘤组织中突变基因及突变类型保持高度一致。作为一项工程技术,能够更高效率、批量化地建立高重现性、高精度的模型。这些优势都使得生物3D打印技术在肿瘤精准医疗研究和临床应用中具有巨大的潜力。
生物3D打印构建流程
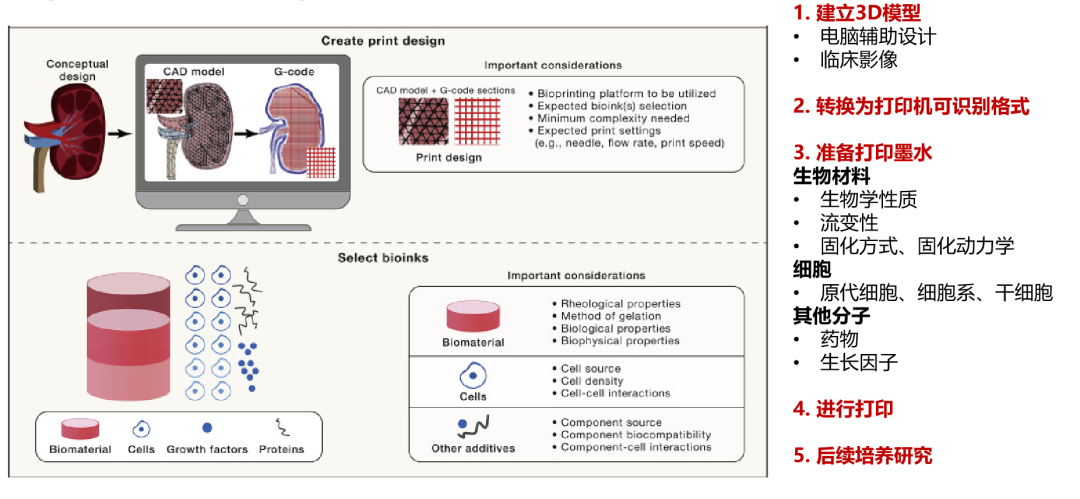
通过生物3D打印建立的肿瘤微组织,可以为患者提供个体化的治疗方案药物敏感性检测,包括类器官可检测的化疗药物、靶向药物。同时,在多种癌种,包括肺癌、结直肠癌等癌种中,生物3D打印为组织中可检测出较高比例免疫细胞,同时由于生物3D打印可以进行不同细胞组合的微组织模型制作,因此也可进行免疫治疗药物的检测,更好地满足患者的需求。
光固化生物3D打印后细胞存活率高、
并维持在体特性
如选择通过生物3D打印技术建立肿瘤微组织,大部分注意事项可参考专家共识针对肿瘤类器官的注意事项,此外运输时间方面相对类器官较为宽裕。目前样本质量、体积达标的情况下,在24小时内送达,均可实现>90%的构建成功率。
生物3D打印作为一种生物制造技术平台即将迭代为一种重要的生命科学工具,利用工程技术构建和模拟人体组织微环境,可涵盖包括类器官、器官芯片等3D模型的制造,从而代替动物实验。在药物研发临床前研究与评价的应用日趋明朗。
✦ ✦✦ ✦✦ ✦✦ ✦
关注我们获取更多咨询

✦ ✦ ✦ ✦ ✦ ✦ ✦ ✦
部分图片文字来自网络,若有侵权,请联系删除。

