《Small》: 生物3D打印的胶质母细胞瘤模型模拟细胞外基质力学性能异质性

1
简介
胶质母细胞瘤(GBM)是最致命的原发性脑肿瘤,其特点是细胞和分子的高度异质性,血管过密,以及先天的耐药。细胞成分和细胞外基质(ECM)是GBM中异质性的两个主要来源。本文中,来自加州大学圣地亚哥分校的Tariq M. Rana和Shaochen Chen团队的Min Tang等作者开发了具有肿瘤区域、无细胞ECM区域和内皮区域的仿生物三区GBM模型,其区域硬度与GBM基质、病理或正常脑实质和脑毛细血管相对应。DLP光固化生物3D打印技术的灵活性和多样化的材料选择允许对肿瘤模型的生物物理特性和生化特性进行正交调制。
源于患者的GBM细胞、人类内皮细胞和透明质酸衍生物被用来建立一个人源化的微环境。这项体外研究表明,生物物理信号参与各种肿瘤细胞行为和血管生成潜力,并调控肿瘤细胞转化为不同分子亚型。硬质模型的转录表达与间充质亚型相似,肿瘤细胞呈弥漫性侵袭,并对替莫唑胺展现更高的药物抗性,同时内皮细胞表现出出芽式血管新生形态。软质模型表现出经典亚型相关通路的富集,肿瘤细胞表现出扩张性细胞生长。本研究采用光固化生物3D打印技术,能够实现快速、灵活和可重复的具有生物物理异质性的患者特异性GBM模型,在未来的研究中可以作为一个可调控的系统来研究GBM疾病机制和筛选药物。
2.1
3D生物打印的GBM模型具有区域不同的生物物理特性
为了再现空间上不均匀的ECM微环境,并探究ECM异质性如何影响GBM的发展和内皮细胞的生长,作者利用DLP 3D生物打印系统和脑瘤特异性ECM衍生的生物墨水,包括GMHA和GelMA,创建四个不同的模型:纯肿瘤的硬质模型、纯肿瘤的软质模型、共培养的硬质模型和共培养的软质模型(图1A)。共培养模型中采用了人脐带血管内皮细胞(HUVECs)打印内皮区域,以包围肿瘤和ECM区域(图1B)。对ECM区域,作者设计了两种不同的硬度,以模仿GBM组织的硬度和健康大脑的硬度(图1C)。作者进一步使用这些具有不同机械性能的3D打印GBM模型,进行在生物物理信号和培养条件下的评估,包括基因表达、药物反应、肿瘤细胞迁移行为和血管生成活动。(图1E)。
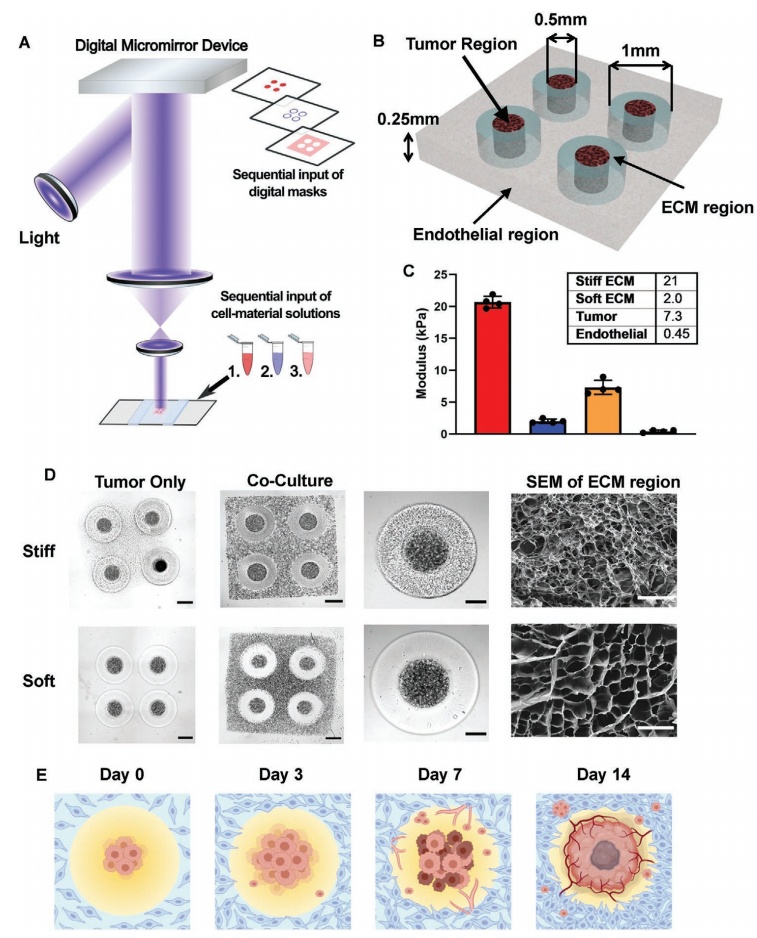
图1. 3D生物打印的GBM模型具有区域性的不同生物物理特性
2.2
与球状体培养相比,3D模型具有不同的转录特征
主成分分析显示,球状体培养与任何一种3D培养相比都有截然不同的转录谱,而两种3D培养之间的差异程度较小(图2A)。一些蛋白编码的癌症相关基因或预后基因在两种3D培养条件下都上调了16倍以上(图2B,C)。与球状体相比,与 DNA复制、细胞周期调控和细胞分裂的通路在3D软质模型中明显富集(图2D)。
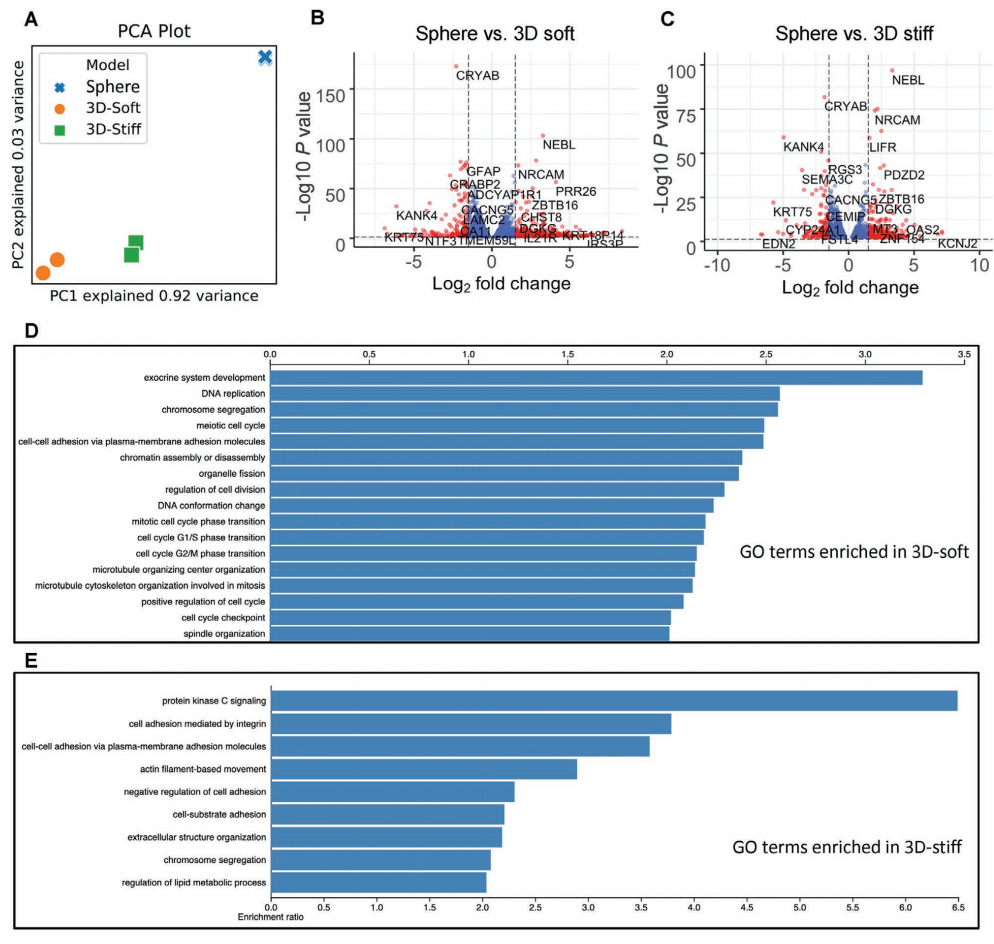
图2. GBM球状体培养和3D模型之间不同的转录谱表达
2.3
硬质模型促进了GBM的缺氧和致瘤性特征
与缺氧、癌症侵袭性、E-cadherin缺失引起的转移,以及对干扰素、炎症、ECM和细胞凋亡等外部刺激的反应的相关基因集在硬质模型中明显富集(图3A,B)。低氧相关的基因,以及低氧相关的血管生成标志物VEGFA和SPP1在硬质模型中都被上调(图3C)。免疫荧光(IF)染色显示,软质模型中存在更多的KI67阳性细胞(图3D)。
2.4
3D模型诱导不同的GBM侵袭模式和转录亚型
TS576细胞和CW468细胞在软质模型中的侵袭面积分别是硬质模型的7倍和4.4倍(图3F)。与从软质模型中分离出的TS576细胞相比,从硬质模型中分离出的TS576细胞高度富含原发性GBM组织特征(图3G),表明硬质模型将细胞转化为更具有临床意义的状态。
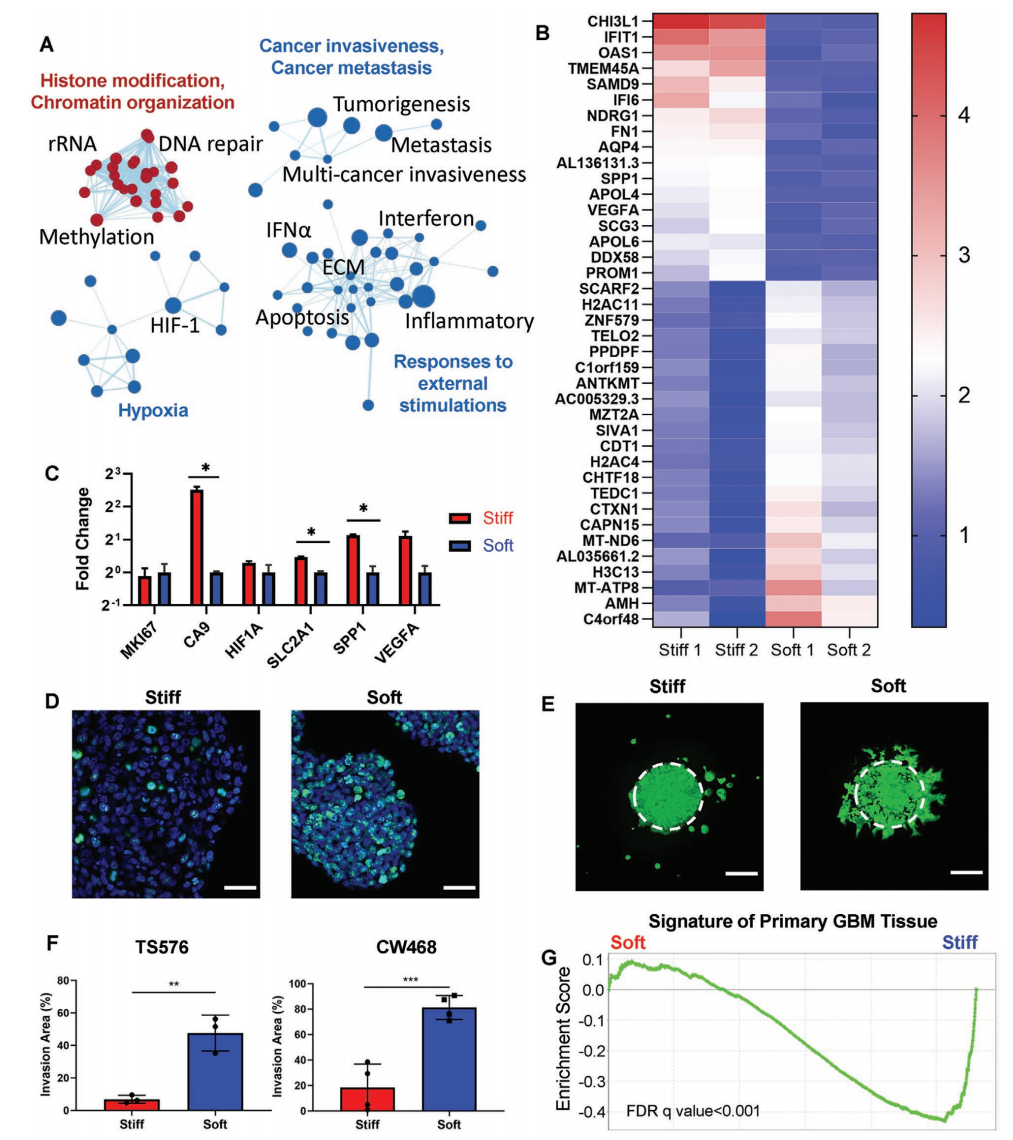
图3. 生物物理模式化诱导了GBM细胞不同的转录图谱和侵袭模式
2.5
内皮细胞在3D打印的模型中表现出不同的生长模式和血管生成
在硬质模型中,迁移的CD31+HUVECs表现出类似出芽的血管新生形态,并与SOX2+GBM细胞紧密接触(图4A)。血管生成标志物SPP1和VEGFA在所有的3D模型中都是上调的,并且在硬质模型或共培养模型中明显富集(图4B)。
2.6
GBM-内皮细胞交流增强了肿瘤的侵袭和抗药性
肿瘤细胞在软质共培养模型中以类纤维细胞形态扩增,而在硬质模型中则以更圆的形态扩增(图4C)。与球状体培养的细胞相比,所有3D生物打印模型中肿瘤细胞都显示出对TMZ的耐药性增强(图4D)。qPCR分析显示,耐药性相关基因如ABCG2和CXCL12在硬质共培养条件下分别上调了8倍和24倍(图4E),与TMZ治疗反应一致。

图4. 硬质模型诱导了内皮细胞的萌芽血管生成,增强了GBM细胞的抗药性
3
结论
本研究中,肿瘤区和内皮区被设计成具有类似于其原始状态的硬度。在肿瘤区和内皮区之间打印了专门设计的ECM区域的两种硬度条件,以模仿GBM重塑的基质或健康的脑实质硬度,并诱导不同的肿瘤细胞生长和行为。细胞在软质模型中迅速增殖和扩增;在硬质模型中,与恶性表型有关的缺氧、干性和血管生成能力得到加强。
肿瘤细胞在两种硬度的微环境中以不同的形态和模式侵入ECM区域。硬质模型中表现出单细胞弥漫性侵袭模式,而软质模型中则表现出扩张性生长模式。这两种侵袭模式都在GBM细胞中被观察到过,这表明硬度变化模型可能适合模拟GBM发展的不同状态。基因集富集分析表明,这两种硬度适合模拟不同的GBM亚型。
血管化是GBM的一个特征,它促进了肿瘤的生长,有利于肿瘤的侵袭。基因表达显示,硬质模型中的肿瘤细胞表达了较高的血管生成标志物,与硬质模型中观察到的出芽表型一致。软质模型促进了细胞的增殖,表现为肿瘤细胞的侵袭面积增大和内皮细胞的增殖。
对所有模型和球体培养对照的TMZ用药处理处理结果显示,硬质共培养模型的肿瘤细胞存活率最高,这表明硬质条件以及与内皮细胞的共培养增强了GBM的抗药性。
本研究中提出的三区硬度模式的GBM模型是第一个将GBM的生理相关的生物物理异质性与生化相关的ECM材料相结合的模型。区域硬度更好地再现了原生环境,并可能有利于更多的生物模拟细胞-ECM和细胞相互作用。未来可用这些模型来研究GBM的不同亚型以及GBM的不同阶段。硬度变化也可应用于未来的模型,研究生物物理对其他肿瘤-基质相互作用的影响。
原文:https://doi.org/10.1002/smll.202006050
关于赛箔生物
赛箔生物致力于开发生物3D打印、生物材料、体外检测组织产品、再生器官产品,并且基于相关产品开发精准的检测评价方法及服务。目前已开展数百例肿瘤临床样本的生物3D打印微组织构建,经过大量实验研究及一致性验证,能够构建与患者组织高度一致的肿瘤微组织用于药敏检测,涵盖癌种包括肺癌、结直肠癌、脑胶质瘤、神经母细胞瘤、肝母细胞瘤、膀胱癌等高发癌种、难治肿瘤、儿童肿瘤,成功率>90%,可实现1-2周内完成采样至完成药敏检测流程。


生物3D打印技术,是一项前沿生物制造技术,能够用于制造例如类器官、器官芯片等具有不同尺寸规格、复杂程度的体外3D细胞组织模型。结合与人体组织高度相似的仿生生物材料及患者细胞,可以精确地复制患者肿瘤组织的细胞及细胞外基质特征。通过生物3D打印建立的肿瘤微组织与患者肿瘤组织中突变基因及突变类型保持高度一致。作为一项工程技术,能够更高效率、批量化地建立高重现性、高精度的模型。这些优势都使得生物3D打印技术在肿瘤精准医疗研究和临床应用中具有巨大的潜力。
生物3D打印构建流程

通过生物3D打印建立的肿瘤微组织,可以为患者提供个体化的治疗方案药物敏感性检测,包括类器官可检测的化疗药物、靶向药物。同时,在多种癌种,包括肺癌、结直肠癌等癌种中,生物3D打印为组织中可检测出较高比例免疫细胞,同时由于生物3D打印可以进行不同细胞组合的微组织模型制作,因此也可进行免疫治疗药物的检测,更好地满足患者的需求。
光固化生物3D打印后细胞存活率高、
并维持在体特性
如选择通过生物3D打印技术建立肿瘤微组织,大部分注意事项可参考专家共识针对肿瘤类器官的注意事项,此外运输时间方面相对类器官较为宽裕。目前样本质量、体积达标的情况下,在24小时内送达,均可实现>90%的构建成功率。
生物3D打印作为一种生物制造技术平台即将迭代为一种重要的生命科学工具,利用工程技术构建和模拟人体组织微环境,可涵盖包括类器官、器官芯片等3D模型的制造,从而代替动物实验。在药物研发临床前研究与评价的应用日趋明朗。
✦ ✦✦ ✦✦ ✦✦ ✦
关注我们获取更多咨询

✦ ✦ ✦ ✦ ✦ ✦ ✦ ✦
部分图片文字来自网络,若有侵权,请联系删除。

