《Nature》:SOX17可使早期结直肠腺瘤和癌症进行免疫逃逸

近日,来自美国MIT的Ömer H. Yilmaz课题组与哈佛医学院的Judith Agudo课题组合作在Nature上发表了研究论文SOX17 enables immune evasion of early colorectal adenomas and cancers。在本研究中,作者利用CRC类器官原位移植方法全面分析了CRC演变过程中的表观基因组和转录组变化,发现促进肿瘤免疫逃逸的关键因子SOX17。机制上,SOX17在CRC中被诱导从而促进肿瘤细胞分化成不被免疫识别的表型,抑制了肿瘤细胞对IFNγ的反应能力,减少了效应CD8+ T细胞的浸润,从而形成了免疫抑制的肿瘤微环境,推动了新生肿瘤的形成和发展。
1
研究背景
高度免疫抑制的微环境是CRCs的特征,并导致对免疫治疗的抵抗。识别这种免疫功能失调的生态系统的机制对于改进目前针对该疾病的免疫治疗方法至关重要。目前的研究主要集中在成熟癌症的免疫分析即免疫抑制环境已经建立的阶段。而在结直肠癌发展的早期阶段,这种免疫抑制环境是如何演变的,仍然知之甚少。而小鼠模型能够在肿瘤发生过程的初始阶段洞察免疫-癌细胞相互作用的未知数。
2
研究内容
首先为了探究结直肠癌的转录组学和表观遗传学变化,作者通过CRISPR-Cas9等技术工程化改造健康小鼠结肠类器官使其表达癌症相关基因Kras、p53和APC的突变与tdTomato荧光,构建了原始AKP类器官。通过结肠镜将这些原始的AKP类器官原位移植到免疫健全的小鼠体内,从产生的原发性肿瘤中生成类器官。通过RNA测序和染色质分析技术检测( ATAC-seq )发现原发性肿瘤来源的AKP类器官表现出与原始AKP类器官明显不同的转录组和染色质可及性变化,具有不同的基因表达模式。这些结果表明作者在体内结肠环境中诱导了CRC来源的初级类器官中稳定的、可遗传的表观遗传学改变。为了鉴定调控这些改变的转录因子,作者整合并比较了RNA-seq DGE和ATAC – seq染色质测序开放启动子峰和基序富集分析,筛选出了SOX17这个内胚层和前肠发育所必需的转录因子。
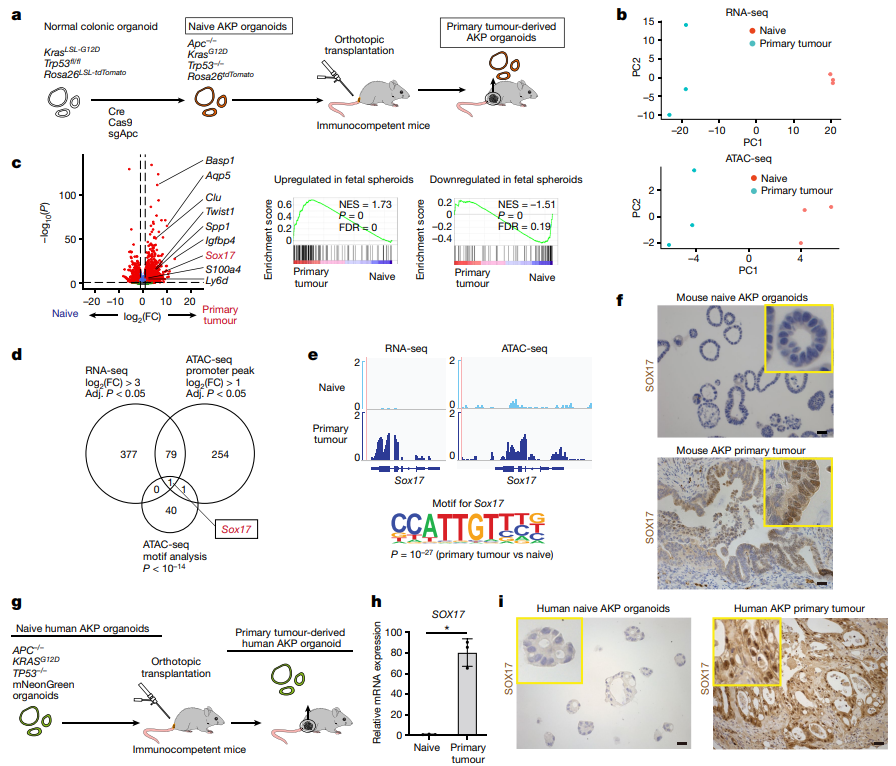
为了明确SOX17在结肠肿瘤发生中的作用,作者利用敲除体内肿瘤来源的AKP类器官中SOX17的表达。SOX17的缺失不影响它们在培养中的生长和增殖。当这些SOX17缺失的AKP类器官被移植到免疫正常小鼠的结肠中时,只有约6 %的受体发生肿瘤,并且肿瘤的大小也显著减小。对照AKP肿瘤浸润程度低,而少数存活的SOX17-null肿瘤表现为强烈的瘤内免疫细胞浸润。这些结果表明,SOX17在体内的表达可能在抑制抗肿瘤免疫反应中发挥重要作用。于是作者将SOX17缺失的AKP类器官移植到免疫缺陷的NCG小鼠或Rag2-/-小鼠体内。结果发现受体小鼠均发生肿瘤,与对照肿瘤相比,肿瘤大小无显著差异。证明SOX17通过免疫细胞促进肿瘤的建立和生长。
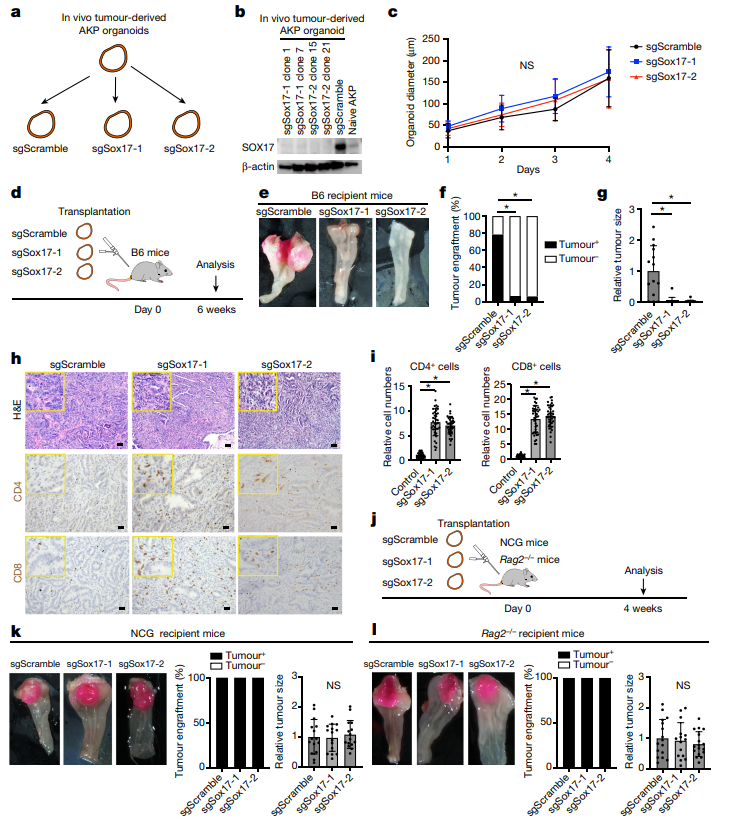
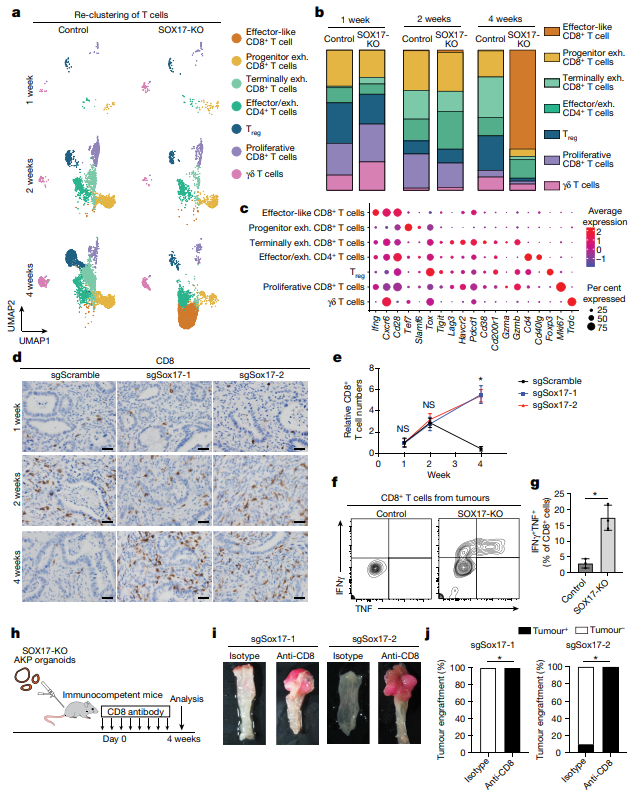
为了研究肿瘤细胞中的SOX17如何控制肿瘤相关免疫微环境的进化,作者在移植sox17敲低AKP类器官后后1,2和4周收集的免疫正常受体的SOX17-null肿瘤和对照的流式分选的CD45+细胞上进行了单细胞RNA – seq。对T细胞重新聚类,在对照肿瘤中,终末期耗尽的CD8+T细胞构成了第4周的CD8+T细胞的主要人群。而具有较强抗肿瘤杀伤能力的效应性CD8+T细胞成为中数量最多的。相反,这种细胞毒性群体仅在对照肿瘤稀疏检测到,与CRCs的免疫抑制环境一致。流式细胞术分析证实,与对照肿瘤相比,SOX17缺失肿瘤中CD8+T细胞产生IFN γ和TNF的能力显著增强。于是作者研究了CD8+和CD4+T细胞在介导SOX17在肿瘤中的作用。在移植sox17敲低AKP类器官后,分别用抗CD8和CD4抗体处理,CD8+T细胞耗竭使所有SOX17缺失的肿瘤生长,表明免疫正常小鼠中SOX17缺失的肿瘤被CD8+T细胞清除。与缺乏CD8+T细胞的小鼠相比,CD4+T细胞缺失小鼠的肿瘤体积明显较小。这些数据表明SOX17缺失的肿瘤中TH1细胞可能支持抗肿瘤CD8+T细胞介导的反应。以上数据表明效应性CD8+T细胞促进了对SOX17缺失肿瘤的排斥反应,而CD4+T效应性TH1细胞在维持和增强CD8+T细胞反应中具有重要作用。
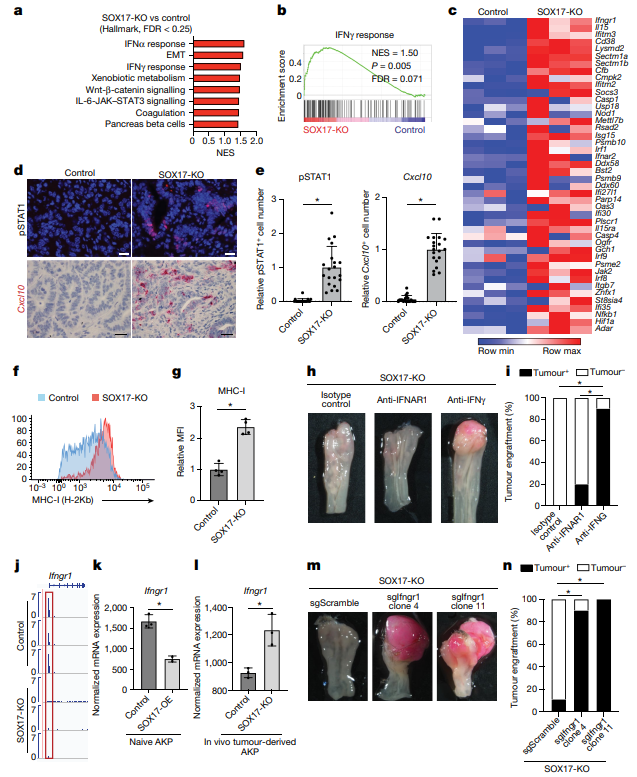
作者对培养的对照和SOX17缺失的小鼠AKP类器官进行了RNA – seq,发现IFN γ应答基因集是SOX17缺失的AKP类器官在体外中上调的顶级通路之一。pSTAT1在SOX17缺失的肿瘤中显著高表达,表明在SOX17缺失的肿瘤细胞中对IFN γ的反应增强。在肿瘤细胞中增强的IFN γ信号通过增加趋化性和抗原呈递,导致活化的CD8+T细胞的募集。此外,IFN γ诱导的趋化因子Cxcl10,可以吸引CD8+T细胞,在SOX17缺失的肿瘤中富集。SOX17缺失的肿瘤中MHC - I的表达水平显著高于对照肿瘤。因此,SOX17缺失的结肠癌细胞能够对IFN γ产生强烈的反应,通过增加MHC - I和CXCL10的表达来增加其免疫原性和募集,从而促进其被CD8+T细胞排斥。因此,在体内肿瘤发生过程中,SOX17的诱导抑制了肿瘤细胞的感知和再生能力。为了研究SOX17在结肠癌细胞中抑制IFN γ信号的机制,作者对SOX17进行了靶向切割和使用核酸酶释放,发现SOX17直接与Ifngr1启动子结合。为了重现SOX17在类器官培养中的强诱导作用,作者在原始AKP类器官中引入了DOX诱导的组成型SOX17-OE构建体,发现SOX17-OE显著下调了中Ifngr1的表达,而SOX17缺失显著上调了其表达。SOX17直接抑制Ifngr1的表达,SOX17敲除的肿瘤表现出增强的IFN γ反应,IFN γ中和可以挽救SOX17缺失的肿瘤。作者推测在免疫健全的受体小鼠中SOX17缺失的肿瘤的排斥反应是由该通路的过度激活介导的。于是作者在SOX17敲除的AKP类器官中删除了IFNGR1,并将其原位移植到免疫正常小鼠体内。IFNGR1的缺失恢复了SOX17缺失的肿瘤细胞定植的能力。表明SOX17在体内诱导抑制了癌细胞中IFN γ信号级联中关键基因的表达,阻止了募集活化的IFN γ产生的效应样CD8+T细胞的前馈环路。这有效地阻止了抗肿瘤T细胞反应的形成,保护了这些结肠癌免受免疫清除。
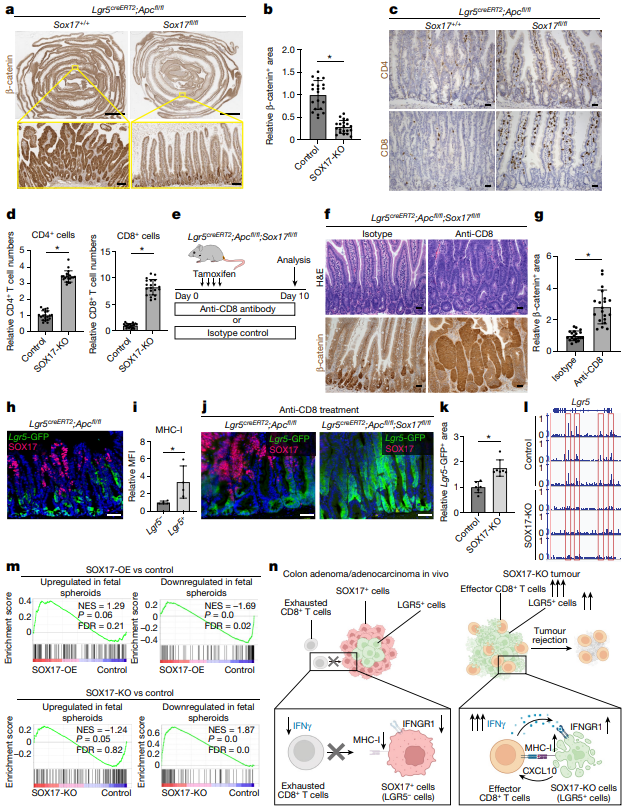
LGR5+肠道干细胞中APC的缺失启动了导致癌前腺瘤形成的级联事件。作者评估了腺瘤-早期结直肠癌转化过程中SOX17表达的哪个步骤在体内被诱导。原发肿瘤来源的Apc- null类器官中Sox17的表达显著高于其原始类器官。表明结肠环境在癌前病变阶段诱导了体内SOX17的表达。为了评估SOX17在肿瘤发生早期的必要性,同时敲除体内LGR5+肠道干细胞中的APC和SOX17,Apc敲除小鼠有效地形成了腺瘤,SOX17的缺失显著降低了肿瘤负荷,表明SOX17在腺瘤形成中的重要作用。这些结果证明,SOX17即使在腺瘤性发育不良的早期阶段,也能避免早期肿瘤的免疫识别。SOX17在早期AKP CRC和其先前的癌前腺瘤中均介导了免疫逃逸程序。通过免疫荧光染色,作者发现LGR5和SOX17是互斥的。富集SOX17表达的Lgr5-肿瘤细胞与Lgr5+肿瘤细胞相比,MHC-I表达显著降低。在腺瘤细胞中SOX17程序的参与驱动了免疫原性较低的LGR5 -肿瘤细胞的产生,从而更有效地允许CD8+T 细胞的免疫逃逸。进一步验证SOX17直接调控LGR5的表达,CUT & RUN分析发现SOX17直接与Lgr5的启动子和内含子结合。SOX17可能作为LGR5的转录抑制因子发挥作用。胎儿肠道基因表达程序的一个标志性特征是LGR5 )的下调,该基因在原发性肿瘤来源的AKP类器官中被强烈诱导,其中SOX17高表达。
3
结论
这些结果共同表明,以上结果表明SOX17在体内介导肿瘤的表观遗传重编程,产生LGR5-细胞,抑制IFN γ信号传导,并促进早期结肠癌肿瘤的免疫逃逸。
本文转载自公众号:本草墨源
文案:金言|排版:董乐轩
文献原文: 10.1016/j.cell.2024.01.040
文献链接:https://www.nature.com/articles/s41586-024-07135-3
关于赛箔生物
赛箔生物是一家专注于生物制造产品和服务的科创企业。产品线包括生物3D打印机、组织解离仪器、动态培养装置等先进设备,不同种类生物材料,体外检测组织以及再生组织产品。并已基于这些产品开发出了一系列精准的检测评价方法及服务,实现了从设备到产品到服务的全面覆盖。
在肿瘤相关领域,赛箔采用生物3D打印技术成功构建了数百例与患者组织高度一致的肿瘤微组织。这些组织可用于药效评价、机制研究,涵盖了十余个癌种,包括高发肿瘤、难治肿瘤、妇科肿瘤和儿童肿瘤,培养成功率超过了90%。临床客户只需1-2周即可获得准确的药敏检测结果,为治疗赢取宝贵时间。
在皮肤相关领域,赛箔开展了围绕细胞和3D组织的创新性研究,开发了皮肤相关体外测试模型及方法,为化妆品、透皮制剂等产品的安全性和功效评价提供专业可靠的服务。


