《Bioactive Materials》:炎症创面修复新突破!

背景
慢性炎症创面修复一直是临床难题,过度炎症反应会导致 M1 型巨噬细胞大量聚集,抑制血管新生和组织再生,最终造成创面迁延不愈。传统修复材料多聚焦单一抗炎或促愈合功能,难以兼顾复杂炎症微环境的动态调控。
近日,汉阳大学团队在《Bioactive Materials》发表创新研究,开发出一种负载单宁酸 - 锶(TA-Sr)纳米颗粒的明胶甲基丙烯酰(GelMA)复合水凝胶(G-TSrP)。该材料通过 “ROS 清除 - 巨噬细胞调控 - 血管化促进” 协同作用,在过度炎症创面模型中实现高效修复,为临床炎症创面治疗提供了多功能纳米治疗新方案。
临床痛点
炎症微环境失衡:过度炎症导致 ROS 大量积累,M1 型巨噬细胞持续富集,抑制 M2 型巨噬细胞极化,阻碍组织修复进程;
血管新生受阻:抗炎成分(如单宁酸)虽能抑制炎症,但会意外抑制血管生成,形成 “抗炎与促血管” 的治疗矛盾;
材料适配性差:传统水凝胶降解速率与组织再生不同步,细胞浸润不足,难以形成功能性新生组织。
研究团队针对性设计了 G-TSrP 复合水凝胶,通过 TA 与 Sr²⁺的协同作用,同时解决炎症调控、血管新生和材料降解三大核心问题。
核心设计
一步法制备 TA-Sr 纳米颗粒(TSrP)
通过金属 - 酚类网络自组装,一步法制备 TSrP 纳米颗粒,实现 TA 与 Sr²⁺的稳定负载。
结构与成分可控:SEM 和 TEM 显示 TSrP 为凸起球形结构,TA 浓度 1mg/mL 时平均粒径 548nm,随着 TA 浓度升高粒径减小.
ROS 清除能力优异:ABTS 实验证实 TSrP 具有强效且长效的自由基清除能力,21 天仍保持稳定活性.
成分协同互补:TA 负责抗炎抗氧化,Sr²⁺弥补 TA 的抗血管缺陷,同时促进细胞增殖与迁移。
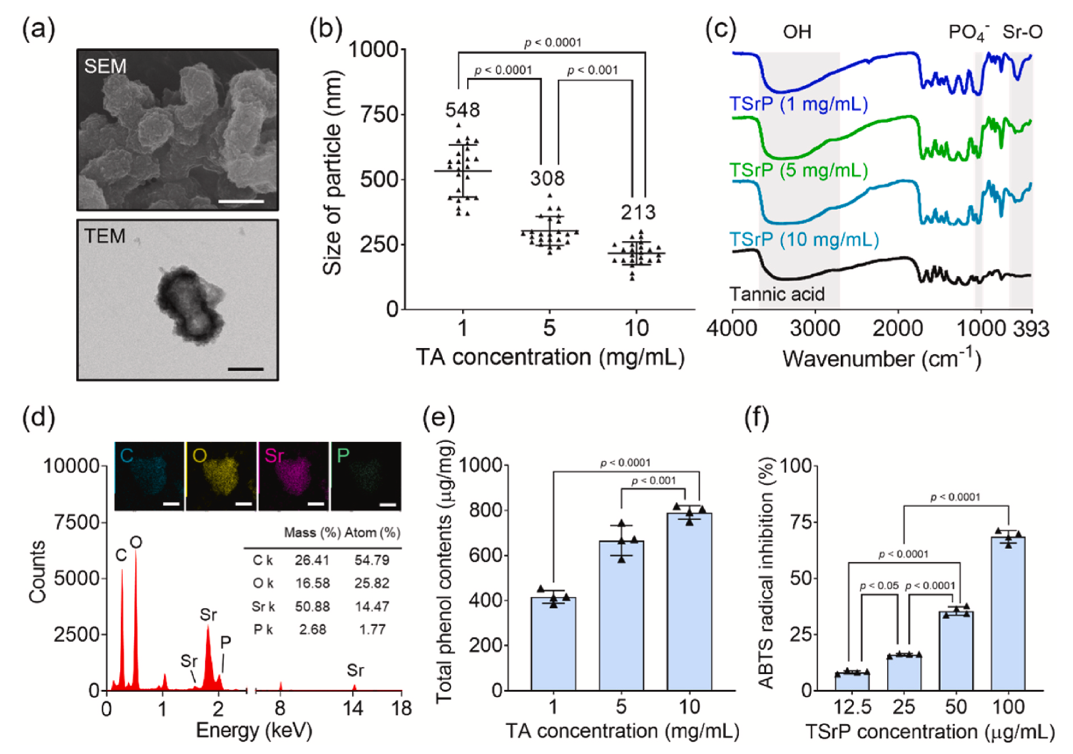
TSrP的制造和表征 (Hayeon et al., 2024)
复合水凝胶的理化特性优化
将 TSrP 嵌入 GelMA 水凝胶,通过光交联形成 G-TSrP 复合水凝胶,兼顾生物相容性与功能稳定性:
结构与力学适配:TSrP 均匀分散于水凝胶内部,增加孔隙率和溶胀率,同时降低杨氏模量,提升材料柔韧性与组织适配性。
ROS 清除与生物安全:G-TSrP 表现出剂量依赖性 ROS 清除能力,且对成纤维细胞、角质形成细胞和内皮细胞无细胞毒性。
可控缓释特性:水凝胶可实现 TA 与 Sr²⁺的持续释放,24 小时释放量分别达 10μM 和 500μM,均处于生物安全浓度范围。
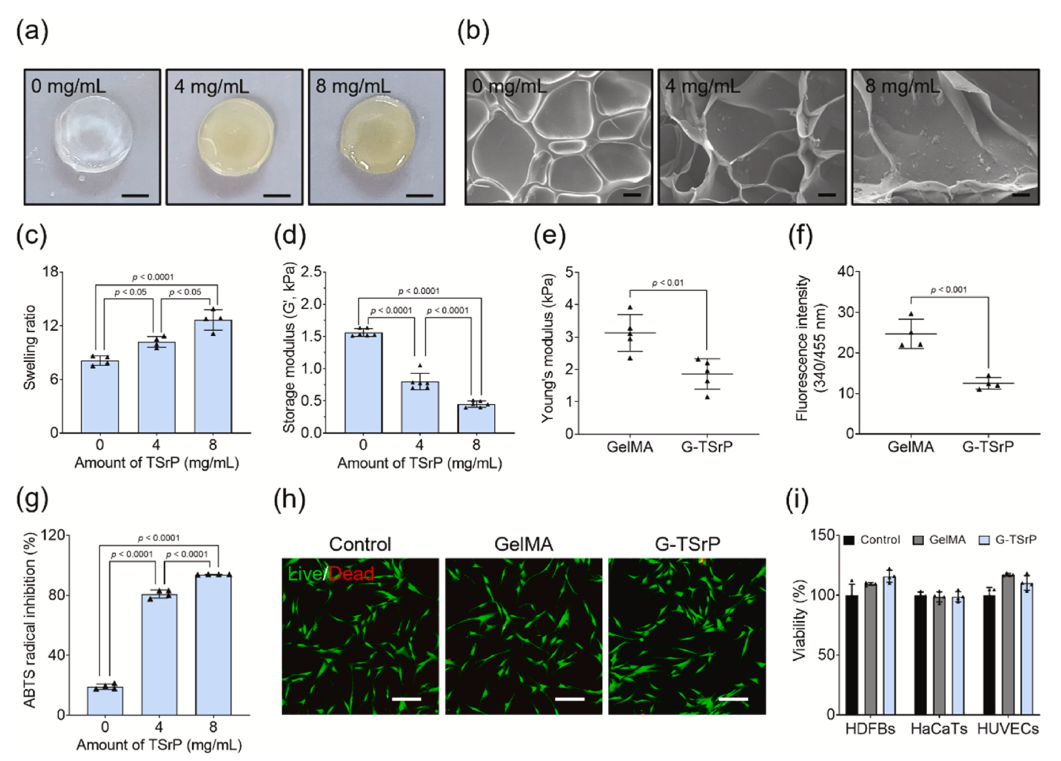
纳米复合材料水凝胶的表征和生物相容性 (Hayeon et al., 2024)
巨噬细胞精准调控
G-TSrP 通过 TA 与 Sr²⁺的协同作用,实现巨噬细胞极化调控:
抑制 M1 型极化:LPS 诱导的 RAW264.7 细胞实验中,G-TSrP 提取物显著降低 iNOS 阳性细胞比例,减少 TNF-α、IL-1β 等促炎基因表达(Figure 5a-b,e);
促进 M2 型极化:IL-4 诱导条件下,G-TSrP 提取物显著提升 CD206 阳性细胞比例,增强 CD163、CD206 等修复相关基因表达,且效果优于单独 TA 处理(Figure 5c-d,f);
增强巨噬细胞迁移与降解功能:G-TSrP 可促进巨噬细胞向创面迁移,同时上调 MMP9、MMP13 基因表达,加速细胞介导的水凝胶降解,同步促进组织重塑(Figure 7d-e)。
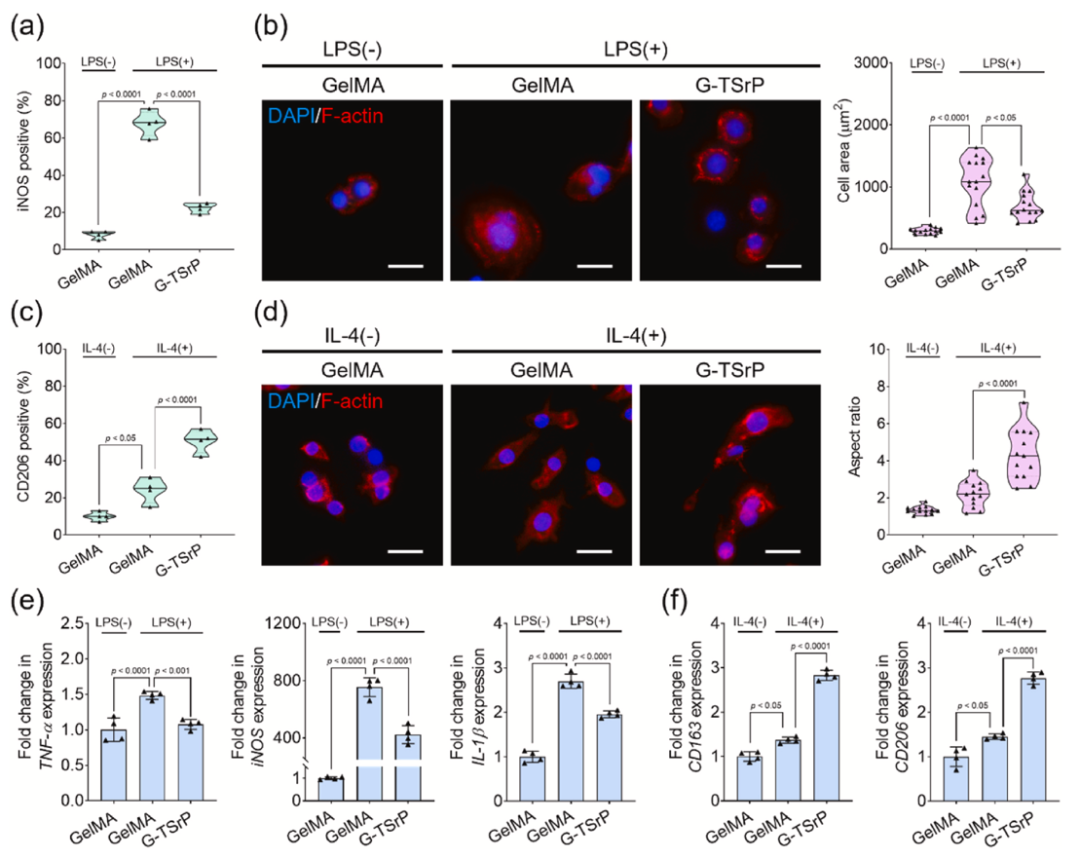
通过G-TSrP调节巨噬细胞极化 (Hayeon et al., 2024)
体内验证
在 LPS 诱导的过度炎症小鼠创面模型中,G-TSrP 表现出显著修复优势
加速创面闭合:术后 6 天 G-TSrP 组创面闭合率显著高于对照组和单独 GelMA 组,21 天创面基本完全愈合(Figure 8b-c)。
促进组织再生:H&E 染色显示,G-TSrP 组创面长度更短,肉芽组织厚度显著增加,表皮厚度接近正常皮肤,毛囊数量较其他组提升 5 倍。
增强血管新生与胶原沉积:CD31 和 α-SMA 免疫荧光显示,G-TSrP 组血管数量和成熟度显著提升,直径>10μm 的小动脉数量明显增加;Masson 三色染色和胶原定量证实,新生组织中胶原 I 沉积致密,接近正常皮肤结构。

体内炎症性伤口愈合 (Hayeon et al., 2024)
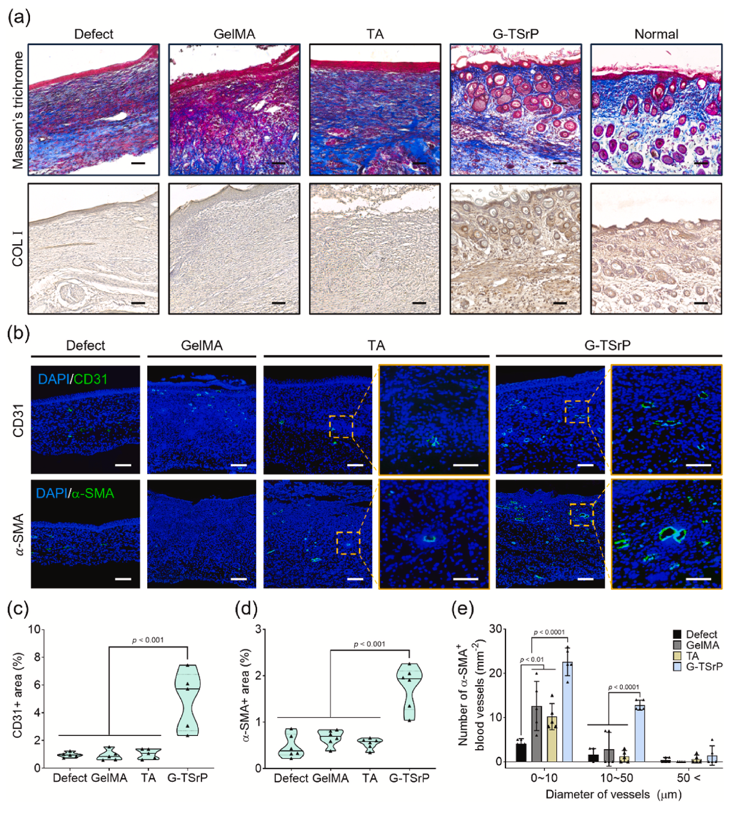
炎症性伤口的组织重塑和血管生成 (Hayeon et al., 2024)
分子机制解析:RNA-seq 揭示巨噬细胞调控核心通路
RNA-seq 分析证实,G-TSrP 通过调控巨噬细胞功能驱动创面修复:
与单独 GelMA 和 TA 处理相比,G-TSrP 组巨噬细胞中 517 个基因显著上调,245 个基因显著下调,主要富集于 “免疫反应调控”“细胞迁移” 和 “血管生成” 相关通路。
机制上,TSrP 释放的 TA 和 Sr²⁺协同作用,招募巨噬细胞并诱导其向 M2 型极化,通过分泌 VEGF 等因子促进血管新生,同时通过 MMPs 介导的水凝胶降解,为组织再生提供空间。
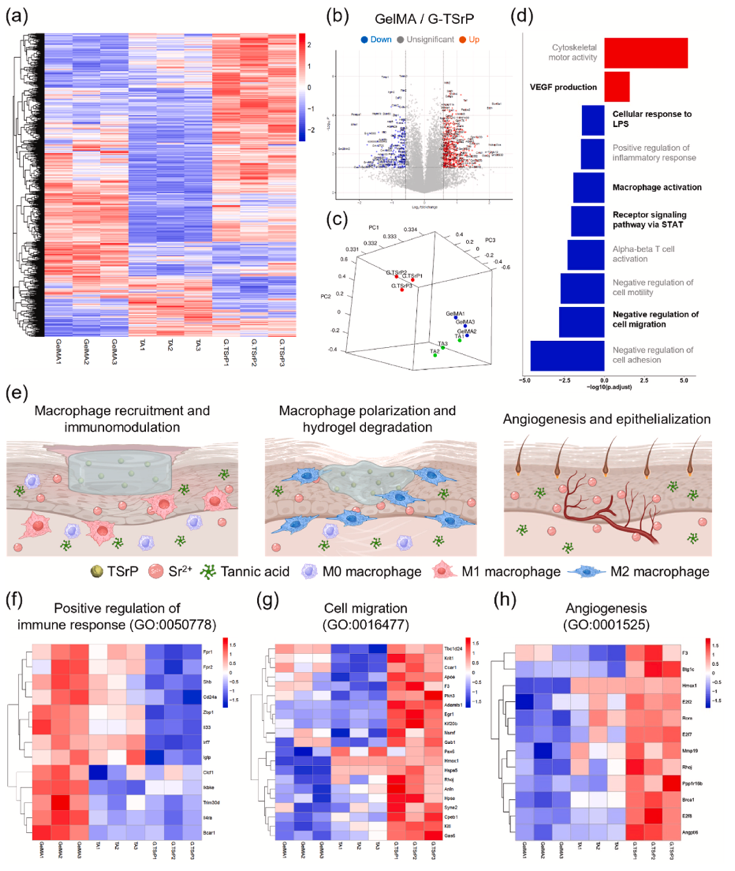
巨噬细胞介导的炎症性伤口愈合的遗传分析 (Hayeon et al., 2024)
临床转化价值
功能协同性强:同时实现 ROS 清除、巨噬细胞极化调控、血管化促进和材料自适应降解,解决炎症创面修复的多重矛盾;
制备简便且安全:TSrP 通过一步法制备,GelMA 水凝胶光交联成型,原料生物相容性优异,符合临床转化要求;
适用范围广:可用于创伤、感染等多种原因导致的炎症创面,尤其适用于慢性炎症创面的精准修复。
总结
该研究成功开发出 TA-Sr 纳米颗粒复合水凝胶 G-TSrP,通过 “材料 - 细胞 - 分子” 多层面调控,实现炎症创面的高效修复。其核心创新在于利用 TA 与 Sr²⁺的协同作用,既发挥 TA 的抗炎抗氧化功能,又通过 Sr²⁺弥补其抗血管缺陷,同时借助巨噬细胞介导的材料降解,同步实现炎症消退、组织再生与血管化。该方案为临床炎症创面治疗提供了全新思路,有望推动多功能纳米生物材料的临床转化应用。
关于赛箔生物
赛箔(上海)智能科技有限公司是一家专注于研发生物制造技术和组织工程产品的高新技术企业,成立于2021年2月。自主研发多种已经获得国家发明专利授权的生物3D打印技术和装备、生物材料、体外细胞和组织培养技术、组织处理和培养装置。基于核心技术开发多种器官组织模型和相应的检测评价服务,为基础研究、新药研发、精准医疗、再生医学等领域提供生物3D打印全产业链解决方案,实现了从设备到产品到服务的全面覆盖。
在肿瘤相关领域,赛箔与合作者共同研发基于生物3D打印技术构建的肿瘤微组织(PDT),涵盖十余个癌种,包括高发肿瘤、难治肿瘤、妇科肿瘤和儿童肿瘤,培养成功率超过了90%。通过近千例样本研究,证实PDT与患者组织具有高度一致的分子特征和药物敏感性,1-2周即可获得准确的药敏检测结果,为治疗赢取宝贵时间,并且可为新药研发企业提供药效评价、入组标准建立、适应症筛选等服务。在再生相关领域,赛箔已建立多种3D组织工程皮肤,包括表皮模型、全层皮肤模型、黑素皮肤模型等,并相应开发多种体外功效测试方法。
肺癌
宫颈癌
结直肠癌
卵巢癌
脑胶质瘤

神经母细胞瘤

黑色素皮肤模型

全层皮肤模型

表皮模型


